









ÍNDICE
1. Propiedades comunes de los gases
2. Ley de Boyle
3. Ley de Charles y Gay-Lussac
4. Temperatura y presión normales
5. La ecuación de las leyes combinada de los gases
6. La ley de Avogadro y el volumen molar normal
7. Ley de Dalton de las presiones parciales
8. Ley de gases ideales
9. La teoría cinético molecular
10. Difusión y efusión de gases
11. Bibliografía
12. SOFTWARE ASOCIADO A LA ENSEÑANZA DE LA QUÍMICA
Propiedades comunes de los gases
Muchas sustancias químicas importantes son gases. La atmósfera terrestre es una mezcla de gases y de partículas de líquidos y sólidos. La mayoría de los componentes gaseosos son N2 (pe -195,79ºC) y O2 (pe -182,98ºC), con concentraciones más pequeñas de otros gases. Todos los gases son miscibles; esto es se mezclan completamente a menos que reacciones entre sí.
Varios científicos, notablemente Torricelli (1643), Boyle (1660), Charles (1787) y Graham (1831), sentaron la base experimental sobre la que se basa la comprensión actual de los gases. Por ejemplo sus investigaciones mostraron propiedades como que:
1. Los gases se pueden comprimir a volúmenes más pequeños esto es, se pueden incrementar sus densidades aplicando una presión creciente
2. Los gases ejercen presión sobre sus alrededores; por el contrario, se debe ejercer presión para confinar a los gases
3. Los gases se expanden sin límites, por lo tanto las muestras de gases ocupan el volumen de cualquier recipiente de forma completa y uniforme
4. Los gases se difunden entre sí, de modo que muestras de gases situadas en el mismo recipiente se mezclan completamente. A la inversa, gases diferentes en una mezcla no se separan al dejarlos en reposo.
5. Las cantidades y propiedades de los gases se describen en términos de temperatura, presión, el volumen ocupado y el número de moles presentes.
LEY DE BOYLE: La relación de presión a volumen
BIOGRAFÍA DE ROBERT BOYLE
EJEMPLO
EJERCICIOS
La relación entre la presión y el volumen de un gas cuando la temperatura es constante fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte. La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante: PV=k
donde k es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen disminuye, mientras que si la presión disminuye el volumen aumenta. El valor exacto de la constante k no es necesario conocerlo para poder hacer uso de la Ley; si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Además Se Obtiene Despejada Que:
P1= P2 * V2/ V1
V1= P2 * V2/P1
P2= P1 * V1/V2
V2= P1 * V1/P2
Donde:
P1= Presión Inicial
P2= Presión Final
V1= Volumen InicialV2= Volumen Final
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Cuando disminuye el volumen la distancia que tienen que recorrer las partículas es menor y por tanto se producen más choques en cada unidad de tiempo: aumenta la presión.
Lo que Boyle descubrió es que si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor.
Como hemos visto, la expresión matemática de esta ley es: Pv=K
(el producto de la presión por el volumen es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presión P1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la presión cambiará a P2, y se cumplirá: P1V1=P2V2
que es otra manera de expresar la ley de Boyle.
Cuando disminuye el volumen la distancia que tienen que recorrer las partículas es menor y por tanto se producen más choques en cada unidad de tiempo: aumenta la presión.
Lo que Boyle descubrió es que si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor.
Como hemos visto, la expresión matemática de esta ley es: Pv=K
(el producto de la presión por el volumen es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presión P1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la presión cambiará a P2, y se cumplirá: P1V1=P2V2
que es otra manera de expresar la ley de Boyle.
BIOGRAFÍA DE ROBERT BOYLE
OBRA DE ROBERT BOYLE
El mayor mérito de Boyle como investigador científico es que materializó los principios que Bacon predijo en su obra Novum Órganum, aunque no se considerara a sí mismo como seguidor de Bacon o cualquier otro profesor: en numerosas ocasiones manifestó que con el propósito de mantener su juicio tan libre de prejuicios como le fuera posible, dado que él se abastecía de experimentos, eludía el estudio de las teorías del átomo, del sistema cartesiano, así como del mismo Novum Órganum, aunque admitía consultar ocasionalmente dichas teorías acerca de algún particular que fuera objeto de su interés. Nada era más ajeno a su temperamento que la hilatura de hipótesis; el apreciaba la adquisición de conocimiento como un fin en sí mismo, y en consecuencia se beneficiaba de una más amplia perspectiva acerca de los fines de la investigación científica de la que tuvieron sus predecesores. Esto, por otro lado, no significa que no prestara atención a las aplicaciones prácticas de la ciencia ni que despreciara el conocimiento que servía al uso.
Boyle publicó en 1661 El químico escéptico y puso fin a los misteriosos manejos de la alquimia y retornó a la teoría atómica de Demócrito. Con sus estudios reavivó el interés de la teoría atómica de la materia.
Realizó importantes contribuciones en el campo de la física: la ley de Boyle, el descubrimiento del papel del aire en la propagación del sonido, las investigaciones acerca de la fuerza expansiva en la congelación del agua, acerca de la gravedad específica, la refracción en cristales, electricidad, color, hidrostática, etc. A pesar de ello, la química fue siempre su predilecta. En 1661 publicó The Sceptical Chemist (El químico escéptico) en la que criticaba los "experimentos por los cuales vulgares espagíricos están acostumbrados a procurarse la evidencia de que su sal, sulfuro y mercurio son los verdaderos principios de las cosas".
Para Boyle, la química era la ciencia de la composición de la sustancias y no un arte auxiliar para el alquimista o el físico. Avanzó hacia la moderna visión de los elementos como los constituyentes de los cuerpos materiales, y comprendió la distinción entre las mezclas y los compuestos realizando progresos considerables en las técnicas para la determinación de sus componentes, un proceso que bautizó como "análisis". Más aún, llegó a suponer que los elementos estaban compuestos en última instancia de partículas de varios tipos y tamaños. Además, realizó estudios acerca de la combustión y la respiración descubriendo la intervención del oxígeno, así como experimentos en fisiología en los que se veía estorbado por la delicadeza de su naturaleza, que le impedía realizar disecciones anatómicas, especialmente de animales vivos, a pesar de saber que eran más instructivas.
Además de ser un atareado filósofo natural, Boyle dedicó mucho tiempo a la teología, mostrando una acusada inclinación a los aspectos prácticos e indiferencia por las polémicas. En 1665 pudo recibir el prebostazgo de Eton de haberse ordenado, algo a lo que se negó en la creencia de que sus escritos sobre temas religiosos tendrían un mayor valor en la medida en que fueran obra de un laico y no de un ministro a sueldo de la iglesia. Gastó grandes sumas en la promoción de la propagación del cristianismo contribuyendo en sociedades misioneras y en los gastos de la traducción de la Biblia o fragmentos de la misma a diferentes idiomas. Por su voluntad se fundaron las conferencias para demostrar la religión cristiana a "infieles notorios, ateos, teístas, paganos, judíos y mahometanos", a condición de que no se mencionaran las controversias entre cristianos
El mayor mérito de Boyle como investigador científico es que materializó los principios que Bacon predijo en su obra Novum Órganum, aunque no se considerara a sí mismo como seguidor de Bacon o cualquier otro profesor: en numerosas ocasiones manifestó que con el propósito de mantener su juicio tan libre de prejuicios como le fuera posible, dado que él se abastecía de experimentos, eludía el estudio de las teorías del átomo, del sistema cartesiano, así como del mismo Novum Órganum, aunque admitía consultar ocasionalmente dichas teorías acerca de algún particular que fuera objeto de su interés. Nada era más ajeno a su temperamento que la hilatura de hipótesis; el apreciaba la adquisición de conocimiento como un fin en sí mismo, y en consecuencia se beneficiaba de una más amplia perspectiva acerca de los fines de la investigación científica de la que tuvieron sus predecesores. Esto, por otro lado, no significa que no prestara atención a las aplicaciones prácticas de la ciencia ni que despreciara el conocimiento que servía al uso.
Boyle publicó en 1661 El químico escéptico y puso fin a los misteriosos manejos de la alquimia y retornó a la teoría atómica de Demócrito. Con sus estudios reavivó el interés de la teoría atómica de la materia.
Realizó importantes contribuciones en el campo de la física: la ley de Boyle, el descubrimiento del papel del aire en la propagación del sonido, las investigaciones acerca de la fuerza expansiva en la congelación del agua, acerca de la gravedad específica, la refracción en cristales, electricidad, color, hidrostática, etc. A pesar de ello, la química fue siempre su predilecta. En 1661 publicó The Sceptical Chemist (El químico escéptico) en la que criticaba los "experimentos por los cuales vulgares espagíricos están acostumbrados a procurarse la evidencia de que su sal, sulfuro y mercurio son los verdaderos principios de las cosas".
Para Boyle, la química era la ciencia de la composición de la sustancias y no un arte auxiliar para el alquimista o el físico. Avanzó hacia la moderna visión de los elementos como los constituyentes de los cuerpos materiales, y comprendió la distinción entre las mezclas y los compuestos realizando progresos considerables en las técnicas para la determinación de sus componentes, un proceso que bautizó como "análisis". Más aún, llegó a suponer que los elementos estaban compuestos en última instancia de partículas de varios tipos y tamaños. Además, realizó estudios acerca de la combustión y la respiración descubriendo la intervención del oxígeno, así como experimentos en fisiología en los que se veía estorbado por la delicadeza de su naturaleza, que le impedía realizar disecciones anatómicas, especialmente de animales vivos, a pesar de saber que eran más instructivas.
Además de ser un atareado filósofo natural, Boyle dedicó mucho tiempo a la teología, mostrando una acusada inclinación a los aspectos prácticos e indiferencia por las polémicas. En 1665 pudo recibir el prebostazgo de Eton de haberse ordenado, algo a lo que se negó en la creencia de que sus escritos sobre temas religiosos tendrían un mayor valor en la medida en que fueran obra de un laico y no de un ministro a sueldo de la iglesia. Gastó grandes sumas en la promoción de la propagación del cristianismo contribuyendo en sociedades misioneras y en los gastos de la traducción de la Biblia o fragmentos de la misma a diferentes idiomas. Por su voluntad se fundaron las conferencias para demostrar la religión cristiana a "infieles notorios, ateos, teístas, paganos, judíos y mahometanos", a condición de que no se mencionaran las controversias entre cristianos
EJEMPLO DE LA LEY DE BOYLE
4.0 L de un gas están a 600.0 mmHg de presión. ¿Cuál será su nuevo volumen si aumentamos la presión hasta 800.0 mmHg?
Solución: Sustituimos los valores en la ecuación P1V1 = P2V2.
(600.0 mmHg) (4.0 L) =(800.0 mmHg) (V2)
Si despejas V2 obtendrás un valor para el nuevo volumen de 3L.
4.0 L de un gas están a 600.0 mmHg de presión. ¿Cuál será su nuevo volumen si aumentamos la presión hasta 800.0 mmHg?
Solución: Sustituimos los valores en la ecuación P1V1 = P2V2.
(600.0 mmHg) (4.0 L) =(800.0 mmHg) (V2)
Si despejas V2 obtendrás un valor para el nuevo volumen de 3L.
V2 = 3L
EJERCICIOS DE APLICACIÓN DE LA LEY DE BOYLE
· Una muestra de gas ocupa 12L a presión de 1,2atm. ¿Cuál sería su volumen si la presión se aumentase a 2,4atm? Supón que la temperatura del gas no varía.
· Una muestra de oxígeno ocupa 10L a una presión de 790torr (105kPa) ¿A qué presión ocuparía 13,4L si la temperatura no cambia?
· Una muestra de 50L de gas recogida en las capas altas de la atmósfera a una presión de 18,3torr se comprime en un recipiente a 150mL a la misma temperatura ¿cuál es la nueva presión en la atmósfera?, ¿a qué volumen tendría que ser comprimida la muestra original para ejercer una presión de 10,0 atm?.
· Un tanque de 10.0 L se llena con helio a una presión de 150 atm. ¿Cuántos globos de juguete de 1.50 L pueden inflarse a condiciones normales con el helio del tanque? Suponer un proceso isotérmico
· Un gas ideal, a 650 torr, ocupa una ampolla de volumen desconocido. Se retiró cierta cantidad de gas que se encontró que ocupaba 1.52 mL a 1.0 atm. La presión del gas restante en la ampolla fue de 600 torr. Suponiendo un proceso isotérmico, calcular el volumen de la ampolla.
· Una muestra de gas ocupa 12L a presión de 1,2atm. ¿Cuál sería su volumen si la presión se aumentase a 2,4atm? Supón que la temperatura del gas no varía.
· Una muestra de oxígeno ocupa 10L a una presión de 790torr (105kPa) ¿A qué presión ocuparía 13,4L si la temperatura no cambia?
· Una muestra de 50L de gas recogida en las capas altas de la atmósfera a una presión de 18,3torr se comprime en un recipiente a 150mL a la misma temperatura ¿cuál es la nueva presión en la atmósfera?, ¿a qué volumen tendría que ser comprimida la muestra original para ejercer una presión de 10,0 atm?.
· Un tanque de 10.0 L se llena con helio a una presión de 150 atm. ¿Cuántos globos de juguete de 1.50 L pueden inflarse a condiciones normales con el helio del tanque? Suponer un proceso isotérmico
· Un gas ideal, a 650 torr, ocupa una ampolla de volumen desconocido. Se retiró cierta cantidad de gas que se encontró que ocupaba 1.52 mL a 1.0 atm. La presión del gas restante en la ampolla fue de 600 torr. Suponiendo un proceso isotérmico, calcular el volumen de la ampolla.
LEY DE CHARLES Y GAY-LUSSAC
Relación entre la temperatura y el volumen de un gas cuando la presión es constante
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
El volumen es directamente proporcional a la temperatura del gas:
•Si la temperatura aumenta, el volumen del gas aumenta.
•Si la temperatura del gas disminuye, el volumen disminuye.
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así:
(el cociente entre el volumen y la temperatura es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:
que es otra manera de expresar la ley de Charles.
Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura.
BIOGRAFÍA DE JACQUES CHARLES
Jacques Alexandre César Charles, químico, físico y aeronauta francés, nació en Beaugency (Loiret) el 2 de noviembre de 1746 y falleció en París el 7 de abril de 1823.
Al tener noticias de las experiencias de los hermanos Montgolfier con su globo aerostático propuso la utilización del hidrógeno, que era el gas más ligero que se conocía entonces, como medio más eficiente que el aire para mantener los globos en vuelo.
En 1783 construyó los primeros globos de hidrógeno y subió él mismo hasta una altura de unos 2 km, experiencia que supuso la locura por la aeronáutica que se desató en la época.
Su descubrimiento más importante fue en realidad un redescubrimiento ya que en 1787 retomó un trabajo anterior de Montons y demostró que los gases se expandían de la misma manera al someterlos a un mismo incremento de temperatura.
El paso que avanzó Charles fue que midió con más o menos exactitud el grado de expansión observó que por cada grado centígrado de aumento de la temperatura el volumen del gas aumentaba 1/275 del que tenía a 0°C . Esto significaba que a una temperatura de -275 °C el volumen de un gas sería nulo (según dicha ley) y que no podía alcanzarse una temperatura más baja.
Dos generaciones más tarde Kelvin fijó estas ideas desarrollando la escala absoluta de temperaturas y definiendo el concepto de cero absoluto.
Charles no público sus experimentos y hacia 1802 Gay-Lussac publicó sus observaciones sobre la relación entre el volumen y la temperatura cuando se mantiene constante la presión por lo que a la ley de Charles también se le llama a veces ley de Charles y Gay-Lussac.Jacques Alexandre César Charles, químico, físico y aeronauta francés, nació en Beaugency (Loiret) el 2 de noviembre de 1746 y falleció en París el 7 de abril de 1823.
Al tener noticias de las experiencias de los hermanos Montgolfier con su globo aerostático propuso la utilización del hidrógeno, que era el gas más ligero que se conocía entonces, como medio más eficiente que el aire para mantener los globos en vuelo.
En 1783 construyó los primeros globos de hidrógeno y subió él mismo hasta una altura de unos 2 km, experiencia que supuso la locura por la aeronáutica que se desató en la época.
Su descubrimiento más importante fue en realidad un redescubrimiento ya que en 1787 retomó un trabajo anterior de Montons y demostró que los gases se expandían de la misma manera al someterlos a un mismo incremento de temperatura.
El paso que avanzó Charles fue que midió con más o menos exactitud el grado de expansión observó que por cada grado centígrado de aumento de la temperatura el volumen del gas aumentaba 1/275 del que tenía a 0°C . Esto significaba que a una temperatura de -275 °C el volumen de un gas sería nulo (según dicha ley) y que no podía alcanzarse una temperatura más baja.
Dos generaciones más tarde Kelvin fijó estas ideas desarrollando la escala absoluta de temperaturas y definiendo el concepto de cero absoluto.
Charles no público sus experimentos y hacia 1802 Gay-Lussac publicó sus observaciones sobre la relación entre el volumen y la temperatura cuando se mantiene constante la presión por lo que a la ley de Charles también se le llama a veces ley de Charles y Gay-Lussac.
Al tener noticias de las experiencias de los hermanos Montgolfier con su globo aerostático propuso la utilización del hidrógeno, que era el gas más ligero que se conocía entonces, como medio más eficiente que el aire para mantener los globos en vuelo.
En 1783 construyó los primeros globos de hidrógeno y subió él mismo hasta una altura de unos 2 km, experiencia que supuso la locura por la aeronáutica que se desató en la época.
Su descubrimiento más importante fue en realidad un redescubrimiento ya que en 1787 retomó un trabajo anterior de Montons y demostró que los gases se expandían de la misma manera al someterlos a un mismo incremento de temperatura.
El paso que avanzó Charles fue que midió con más o menos exactitud el grado de expansión observó que por cada grado centígrado de aumento de la temperatura el volumen del gas aumentaba 1/275 del que tenía a 0°C . Esto significaba que a una temperatura de -275 °C el volumen de un gas sería nulo (según dicha ley) y que no podía alcanzarse una temperatura más baja.
Dos generaciones más tarde Kelvin fijó estas ideas desarrollando la escala absoluta de temperaturas y definiendo el concepto de cero absoluto.
Charles no público sus experimentos y hacia 1802 Gay-Lussac publicó sus observaciones sobre la relación entre el volumen y la temperatura cuando se mantiene constante la presión por lo que a la ley de Charles también se le llama a veces ley de Charles y Gay-Lussac.Jacques Alexandre César Charles, químico, físico y aeronauta francés, nació en Beaugency (Loiret) el 2 de noviembre de 1746 y falleció en París el 7 de abril de 1823.
Al tener noticias de las experiencias de los hermanos Montgolfier con su globo aerostático propuso la utilización del hidrógeno, que era el gas más ligero que se conocía entonces, como medio más eficiente que el aire para mantener los globos en vuelo.
En 1783 construyó los primeros globos de hidrógeno y subió él mismo hasta una altura de unos 2 km, experiencia que supuso la locura por la aeronáutica que se desató en la época.
Su descubrimiento más importante fue en realidad un redescubrimiento ya que en 1787 retomó un trabajo anterior de Montons y demostró que los gases se expandían de la misma manera al someterlos a un mismo incremento de temperatura.
El paso que avanzó Charles fue que midió con más o menos exactitud el grado de expansión observó que por cada grado centígrado de aumento de la temperatura el volumen del gas aumentaba 1/275 del que tenía a 0°C . Esto significaba que a una temperatura de -275 °C el volumen de un gas sería nulo (según dicha ley) y que no podía alcanzarse una temperatura más baja.
Dos generaciones más tarde Kelvin fijó estas ideas desarrollando la escala absoluta de temperaturas y definiendo el concepto de cero absoluto.
Charles no público sus experimentos y hacia 1802 Gay-Lussac publicó sus observaciones sobre la relación entre el volumen y la temperatura cuando se mantiene constante la presión por lo que a la ley de Charles también se le llama a veces ley de Charles y Gay-Lussac.
BIOGRAFÍA DE GAY-LUSSAC
Químico y físico francés, nacido el 6 de diciembre de 1778, en Saint-Léonard-de-Noblat, y fallecido el 9 de mayo de 1850, en París.
Además de ocupar cargos políticos de importancia, Gay-Lussac fue catedrático de Física (a partir de 1808) en la Universidad de la Sorbona, así como catedrático de Química (a partir de 1809) en el Instituto Politécnico de París.
En 1802 publicó los resultados de sus experimentos que, ahora conocemos como Ley de Gay-Lussac. Esta ley establece, que, a volumen constante, la presión de una masa fija de un gas dado es directamente proporcional a la temperatura Kelvin.
En el campo de la física llevó a cabo, en 1804, dos ascensiones en globo, hasta altitudes de 7.000 metros, en las que estudió la composición de las capas altas de la atmósfera y el magnetismo terrestre.
Entre 1805 y 1808 dió a conocer la ley de los volúmenes de combinación, que afirma que los volúmenes de los gases que intervienen en una reacción química (tanto de reactivos como de productos) están en la proporción de números enteros sencillos.
En relación con estos estudios, investigó junto con el naturalista alemán Alexander von Humboldt, la composición del agua, descubriendo que se compone de dos partes de hidrógeno por una de oxígeno.
En 1811 dió forma a la ley que Charles había descubierto en 1787 sobre la relación entre el volumen y la temperatura, pero que había quedado sin publicar. Este mismo año, el químico francés Courtois, por medio de una reacción química produjo un gas de color violeta que Gay-Lussac identificó como un nuevo elemento y le dio el nombre de yodo, que en griego significa violeta.
Estudió también el ácido cianhídrico así como el gas de hulla. En el año 1835 creó un procedimiento para la producción de ácido sulfúrico basado en el empleo de la torre llamada de Gay-Lussac.
Gracias a sus mediciones químicas de precisión y a sus procedimientos exactos de trabajo, logró obtener varios elementos químicos y establecer las bases del análisis volumétrico convirtiéndolo en una disciplina independiente.
En la lucha de prestigio entre Francia e Inglaterra, Napoleón suministró fondos a Gay-Lussac para que construyera una batería eléctrica mayor que la de Davy, y así encontrar nuevos elementos.
La batería no fue necesaria, pues Gay-Lussac y Thenard empleando el potasio descubierto por Davy, aislaron el boro sin necesidad de la electricidad. Al tratar óxido de boro con potasio se produjo el elemento boro. En 1809 Gay-Lussac trabajó en la preparación del potasio e investigó las propiedades del cloro. En el campo de la industria química desarrolló mejoras en varios procesos de fabricación y ensayo. En 1831 fue elegido miembro de la Cámara de los Diputados y en 1839 del Senado
Químico y físico francés, nacido el 6 de diciembre de 1778, en Saint-Léonard-de-Noblat, y fallecido el 9 de mayo de 1850, en París.
Además de ocupar cargos políticos de importancia, Gay-Lussac fue catedrático de Física (a partir de 1808) en la Universidad de la Sorbona, así como catedrático de Química (a partir de 1809) en el Instituto Politécnico de París.
En 1802 publicó los resultados de sus experimentos que, ahora conocemos como Ley de Gay-Lussac. Esta ley establece, que, a volumen constante, la presión de una masa fija de un gas dado es directamente proporcional a la temperatura Kelvin.
En el campo de la física llevó a cabo, en 1804, dos ascensiones en globo, hasta altitudes de 7.000 metros, en las que estudió la composición de las capas altas de la atmósfera y el magnetismo terrestre.
Entre 1805 y 1808 dió a conocer la ley de los volúmenes de combinación, que afirma que los volúmenes de los gases que intervienen en una reacción química (tanto de reactivos como de productos) están en la proporción de números enteros sencillos.
En relación con estos estudios, investigó junto con el naturalista alemán Alexander von Humboldt, la composición del agua, descubriendo que se compone de dos partes de hidrógeno por una de oxígeno.
En 1811 dió forma a la ley que Charles había descubierto en 1787 sobre la relación entre el volumen y la temperatura, pero que había quedado sin publicar. Este mismo año, el químico francés Courtois, por medio de una reacción química produjo un gas de color violeta que Gay-Lussac identificó como un nuevo elemento y le dio el nombre de yodo, que en griego significa violeta.
Estudió también el ácido cianhídrico así como el gas de hulla. En el año 1835 creó un procedimiento para la producción de ácido sulfúrico basado en el empleo de la torre llamada de Gay-Lussac.
Gracias a sus mediciones químicas de precisión y a sus procedimientos exactos de trabajo, logró obtener varios elementos químicos y establecer las bases del análisis volumétrico convirtiéndolo en una disciplina independiente.
En la lucha de prestigio entre Francia e Inglaterra, Napoleón suministró fondos a Gay-Lussac para que construyera una batería eléctrica mayor que la de Davy, y así encontrar nuevos elementos.
La batería no fue necesaria, pues Gay-Lussac y Thenard empleando el potasio descubierto por Davy, aislaron el boro sin necesidad de la electricidad. Al tratar óxido de boro con potasio se produjo el elemento boro. En 1809 Gay-Lussac trabajó en la preparación del potasio e investigó las propiedades del cloro. En el campo de la industria química desarrolló mejoras en varios procesos de fabricación y ensayo. En 1831 fue elegido miembro de la Cámara de los Diputados y en 1839 del Senado
EJEMPLO DE LA LEY DE CHARLES Y GAY-LUSSAC
Un gas tiene un volumen de 2.5 L a 25 °C. ¿Cuál será su nuevo volumen si bajamos la temperatura a 10 °C?
Recuerda que en estos ejercicios siempre hay que usar la escala Kelvin.
Solución: Primero expresamos la temperatura en kelvin:
T1 = (25 + 273) K= 298 K
T2 = (10 + 273 ) K= 283 K
Ahora sustituimos los datos en la ecuación:
Si despejas V2 obtendrás un valor para el nuevo volumen de 2.37 L
Un gas tiene un volumen de 2.5 L a 25 °C. ¿Cuál será su nuevo volumen si bajamos la temperatura a 10 °C?
Recuerda que en estos ejercicios siempre hay que usar la escala Kelvin.
Solución: Primero expresamos la temperatura en kelvin:
T1 = (25 + 273) K= 298 K
T2 = (10 + 273 ) K= 283 K
Ahora sustituimos los datos en la ecuación:
Si despejas V2 obtendrás un valor para el nuevo volumen de 2.37 L
EJERCICIOS DE APLICACIÓN DE LA LEY DE CHARLES Y GAY-LUSSAC
· Un gas ocupa un volumen de 31,0L a 17ºC. Si la temperatura del gas sube a 34ºC a presión constante, ¿esperarías que se duplicara el volumen a 62L?. Explica tu respuesta y calcula el nuevo volumen a 34ºC, a400ºK y a -34ºC.
· Una muestra de Helio ocupa 90,0mL a 25ºC. ¿a qué temperatura en ºC se debe enfriar a presión constante, para reducir el volumen a 30mL
· ¿Cuáles de las siguientes afirmaciones son verdaderas? ¿Cuáles son falsas? ¿Por qué? Supón presión constante para cada caso
a. Si una muestra de gas se calienta de 100ºC a 200ºC el volumen se duplicará
b. Si una muestra de gas se calienta de 0ºC a 273ºC el volumen se duplicará
c. Si una muestra de gas se enfría de 1273ºC a 500ºC, el volumen se reducirá por un factor de dos
d. Si una muestra de gas se enfría de 1000ºC a 200ºC el volumen se reducirá por un factor de 5
e. Si una muestra de gas se calienta a 473ºC a 1219ºC, el volumen se duplicará por un factor de dos.
· Un gas ocupa un volumen de 31,0L a 17ºC. Si la temperatura del gas sube a 34ºC a presión constante, ¿esperarías que se duplicara el volumen a 62L?. Explica tu respuesta y calcula el nuevo volumen a 34ºC, a400ºK y a -34ºC.
· Una muestra de Helio ocupa 90,0mL a 25ºC. ¿a qué temperatura en ºC se debe enfriar a presión constante, para reducir el volumen a 30mL
· ¿Cuáles de las siguientes afirmaciones son verdaderas? ¿Cuáles son falsas? ¿Por qué? Supón presión constante para cada caso
a. Si una muestra de gas se calienta de 100ºC a 200ºC el volumen se duplicará
b. Si una muestra de gas se calienta de 0ºC a 273ºC el volumen se duplicará
c. Si una muestra de gas se enfría de 1273ºC a 500ºC, el volumen se reducirá por un factor de dos
d. Si una muestra de gas se enfría de 1000ºC a 200ºC el volumen se reducirá por un factor de 5
e. Si una muestra de gas se calienta a 473ºC a 1219ºC, el volumen se duplicará por un factor de dos.
Según la ley de Gay-Lussac esta misma relación es la que ocurre entre los volúmenes de los gases en una reacción química. Por ello, debe de existir una relación directa entre éstos volúmenes de gases y el número de moléculas que contienen.
La ley de Avogadro dice que:
"Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas"
También el enunciado inverso es cierto: "Un determinado número de moléculas de dos gases diferentes ocupan el mismo volumen en idénticas condiciones de presión y temperatura".
Esta ley suele enunciarse actualmente también como: "La masa atómica o átomo-gramo de diferentes elementos contienen el mismo número de átomos".
Tal como se mencionó el estudio de los gases atrajo la atención del físico italiano Amadeo Avogadro, que en 1811 formuló una importante ley que lleva su nombre. Esta ley afirma que dos volúmenes iguales de gases diferentes contienen el mismo número de moléculas si sus condiciones de temperatura y presión son las mismas. Si se dan esas condiciones, dos botellas idénticas, una llena de oxígeno y otra de helio, contendrán exactamente el mismo número de moléculas. Sin embargo, el número de átomos de oxígeno será dos veces mayor puesto que el oxígeno es diatómico.
De la ley de Avogadro se desprende que las masas de un volumen patrón de diferentes gases (es decir, sus densidades) son proporcionales a la masa de cada molécula individual de gas.
Si se toma el átomo de carbono como patrón y se le asigna un valor de 12,0000 unidades de masa atómica (u), esto quiere decir que el átomo de carbono tiene una masa de 12. A partir de esto nosotros podemos determinar la masa atómica de otros elementos de la tabla periódica, como el hidrógeno. Así, el hidrógeno tiene una masa atómica de 1,0079 u; el helio, de 4,0026 u; el flúor, de 18,9984 u, y el sodio, de 22,9898 u.
La observación de que muchas masas atómicas se aproximan a números enteros llevó al químico británico William Prout a sugerir, en 1816, que todos los elementos podrían estar compuestos por átomos de hidrógeno. No obstante, medidas posteriores de las masas atómicas demostraron que el cloro, por ejemplo, tiene una masa atómica de 35,453 (si se asigna al carbono el valor 12).
Muchas veces se habla de “peso atómico”, pero lo correcto es “masa atómica”. La masa es una propiedad del cuerpo, mientras que el peso es la fuerza ejercida sobre el cuerpo a causa de la gravedad.
El descubrimiento de estas masas atómicas fraccionarias pareció invalidar la hipótesis de Prout hasta un siglo después, cuando se descubrió que, por lo general, los átomos de un elemento dado no tienen todos la misma masa.
En resumen se tienen que a temperatura y presión constante, el volumen ocupado por una muestra de gas es directamente proporcional al número de moles de gas
V α n o V = kn (P,T constantes)
Para muestras diferentes de gas a la misma temperatura y presión, la relación entre los volúmenes y número de moles se puede representar como :
La ley de Avogadro dice que:
"Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas"
También el enunciado inverso es cierto: "Un determinado número de moléculas de dos gases diferentes ocupan el mismo volumen en idénticas condiciones de presión y temperatura".
Esta ley suele enunciarse actualmente también como: "La masa atómica o átomo-gramo de diferentes elementos contienen el mismo número de átomos".
Tal como se mencionó el estudio de los gases atrajo la atención del físico italiano Amadeo Avogadro, que en 1811 formuló una importante ley que lleva su nombre. Esta ley afirma que dos volúmenes iguales de gases diferentes contienen el mismo número de moléculas si sus condiciones de temperatura y presión son las mismas. Si se dan esas condiciones, dos botellas idénticas, una llena de oxígeno y otra de helio, contendrán exactamente el mismo número de moléculas. Sin embargo, el número de átomos de oxígeno será dos veces mayor puesto que el oxígeno es diatómico.
De la ley de Avogadro se desprende que las masas de un volumen patrón de diferentes gases (es decir, sus densidades) son proporcionales a la masa de cada molécula individual de gas.
Si se toma el átomo de carbono como patrón y se le asigna un valor de 12,0000 unidades de masa atómica (u), esto quiere decir que el átomo de carbono tiene una masa de 12. A partir de esto nosotros podemos determinar la masa atómica de otros elementos de la tabla periódica, como el hidrógeno. Así, el hidrógeno tiene una masa atómica de 1,0079 u; el helio, de 4,0026 u; el flúor, de 18,9984 u, y el sodio, de 22,9898 u.
La observación de que muchas masas atómicas se aproximan a números enteros llevó al químico británico William Prout a sugerir, en 1816, que todos los elementos podrían estar compuestos por átomos de hidrógeno. No obstante, medidas posteriores de las masas atómicas demostraron que el cloro, por ejemplo, tiene una masa atómica de 35,453 (si se asigna al carbono el valor 12).
Muchas veces se habla de “peso atómico”, pero lo correcto es “masa atómica”. La masa es una propiedad del cuerpo, mientras que el peso es la fuerza ejercida sobre el cuerpo a causa de la gravedad.
El descubrimiento de estas masas atómicas fraccionarias pareció invalidar la hipótesis de Prout hasta un siglo después, cuando se descubrió que, por lo general, los átomos de un elemento dado no tienen todos la misma masa.
En resumen se tienen que a temperatura y presión constante, el volumen ocupado por una muestra de gas es directamente proporcional al número de moles de gas
V α n o V = kn (P,T constantes)
Para muestras diferentes de gas a la misma temperatura y presión, la relación entre los volúmenes y número de moles se puede representar como :
TEMPERATURA Y PRESIÓN NORMALES
Como se ha visto tanto la temperatura como la presión afectan a los volúmenes (y por tanto a las densidades) de los gases. A veces es conveniente escoger alguna temperatura y presión <> como punto de referencia para la discusión de gases. La temperatura y presión normal (PTN) son, por acuerdo internacional, 0ºC (273,15ºK) y una atmósfera de presión (760 torr).
Como se ha visto tanto la temperatura como la presión afectan a los volúmenes (y por tanto a las densidades) de los gases. A veces es conveniente escoger alguna temperatura y presión <
LA ECUACIÓN DE LAS LEYES COMBINADA DE LOS GASES
La ley de Boyle relaciona presiones y volúmenes de una muestra de gas a temperatura constante, P1V1=P2V2. La ley de Charles relaciona volúmenes y temperaturas a presión constante V1/T1=V2/T2. La combinación de la ley de Boyle y la ley de Charles en una sola expresión da la ecuación de las leyes combinadas de los gases.
(n constante)
Cuando se conocen 5 variables de la ecuación la sexta se puede calcular
(n constante)
Cuando se conocen 5 variables de la ecuación la sexta se puede calcular
El volumen ocupado por un mol de gas a presión y normal, PTN, se conoce como el volumen molar normal. Es casi constante para todos los gases.
El VOLUMEN MOLAR NORMAL de un gas tiene un valor de 22,414L por mol a PTN.
El VOLUMEN MOLAR NORMAL de un gas tiene un valor de 22,414L por mol a PTN.
BIOGRAFÍA DE AMEDEO AVOGADRO
El Conde Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto (Vercelli), hijo del magistrado Filippo y Anna Vercellone di Biella, nació en Turín el 9 de agosto de 1776 y murió en la misma ciudad el 9 de julio de 1856. El apellido de la familia se remonta a una antigua costumbre, por la que a los abogados que habían prestado servicios a las iglesias se les autorizaba a transmitir a sus herederos la profesión de las leyes. Con el transcurrir del tiempo, podía suceder que el apellido de algunas familias se perdiera y lo substituyera un simple de Advocatis, del cual derivarían Advocarii, Avogarii, Avogadri.
En 1789 Amedeo Avogadro se graduó en filosofía, algunos años más tarde en jurisprudencia, y en 1796 obtuvo el nombramiento oficial de doctor en ley eclesiástica, que le permitió desempeñarse en el Ufficio dei poveri y posteriormente en la Avvocatura generale.
En 1801 el gobierno de la República Francesa lo nombró secretario de la Prefectura del Departamento del Eridano. Pero en realidad lo que realmente interesaba al joven Avogadro era el campo de las ciencias, y muy particularmente los estudios de física y matemática, enriquecidos por las estimulantes innovaciones de la época. En 1800 llegó a ser discípulo del insigne físico y matemático Vassalli Eandi.
En 1806, tras un período de cinco años de estudio, fue nombrado profesor auxiliar en el Regio Collegio delle Province de Turín y pocos años después (1809), profesor de matemática y física en el Liceo o Collegio de Vercelli, donde conservó su cargo hasta 1819.
Con la creación de la Universidad de Turín, por decreto del rey Víctor Manuel I el 6 de noviembre de 1820, Avogadro asume la dirección de la primera cátedra de física sublime, que desempeñó tan sólo hasta 1821, cuando, a raíz de los movimientos revolucionarios, se suspendieron muchas cátedras universitarias, sin ninguna consideración por los méritos científicos de los respectivos docentes. En realidad, como es sabido, de este modo se deseaba castigar no tanto a las personas, como a la institución universitaria, crisol de ideas de progreso y por ende, de reflexión, es decir castigar ¡a la ciencia! El físico turinés fue designado entonces Mastro Uditore de la Cámara Real de Cuentas. En 1832 Carlo Alberto rehabilitó las cátedras universitarias suspendidas por su predecesor, y Avogadro, dados sus grandes méritos científicos, recuperó su cargo, que desempeñó desde 1834 hasta 1850, año en que cedió la docencia a su discípulo Felice Chiò.
Los biógrafos lo describen como un hombre de temple excepcional, de férrea voluntad y extraordinaria capacidad de dedicación al trabajo. Consolidaba y corroboraba su cultura científica un vasto conocimiento de las letras, la filosofía y los tratados jurídicos. Avogadro dividía su tiempo entre el estudio, la docencia y su familia, y pese al relativo deshogo que le procuraban los éxitos, llevaba un tren de vida moderado, exento de excesos y jactancia. Se encontraba siempre dispuesto a la confrontación, y manifestaba asimismo una particular sensibilidad por la formación científica de los jóvenes estudiantes que le eran encomendados.
Su amigo Felice Romani, quien le tenía en suma estima, anunciaba la muerte del químico turinés, acaecida en 1856, en lo siguientes términos: Con la bondad del corazón se correspondía en Avogadro la gentileza de su persona: ojos vivaces pero de mirada serena, dulce y expresiva fisonomía, labios elocuentes, trato cortés, modales afectuosos y sinceros; garbo y vigor en gráciles miembros. Religioso sin intolerancia, docto sin pedantería, sabio sin ostentación, enemigo del fasto, despreocupado por la riqueza, sin ambición a los honores, desconocedor de sus méritos y reputación, modesto, sobrio, afectuoso.La carrera científica de Avogadro se encuentra íntimamente ligada a los estudios sobre la electricidad realizados por Volta. Entre 1806 y 1807 el químico turinés publicó una memoria sobre los cuerpos aislantes, posteriormente denominados dieléctricos por Faraday. Avogadro admitió que en dichos cuerpos se generan alternadamente estados moleculares negativos y positivos que acaban volviéndolos neutros en su conjunto. Dedujo, además, que todos los fenómenos eléctricos pueden resumirse en fenómenos químicos. Algunos años más tarde se interesó por el concepto de acidez de base de las sustancias y describió los hidrácidos como ácidos sin oxígeno. Estableció la primera tabla de potenciales electroquímicos de los elementos, distribuyendo los ya conocidos en una sucesión en cuyos extremos se encontraban respectivamente los elementos más electronegativos y los más electropositivos.
Cuando en 1808 Gay-Lussac (1778-1850) enunció las leyes de combinación de los elementos en estado gaseoso (Proust [1754-1826) había publicado la ley de las proporciones definidas en 1801), Avogadro relacionó éstas con la hipótesis atómica de John Dalton (1766-1844), publicada en el New System of Chemical Philosophy (1808).
Sus reflexiones dieron por fruto una memoria publicada en 1811, titulada en francés: Essai d'une manière de déterminer les masses relatives des molécules élementaires des corps et les proportions selon lesquelles elles entrent dans ces combinaisons.
El Conde Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto (Vercelli), hijo del magistrado Filippo y Anna Vercellone di Biella, nació en Turín el 9 de agosto de 1776 y murió en la misma ciudad el 9 de julio de 1856. El apellido de la familia se remonta a una antigua costumbre, por la que a los abogados que habían prestado servicios a las iglesias se les autorizaba a transmitir a sus herederos la profesión de las leyes. Con el transcurrir del tiempo, podía suceder que el apellido de algunas familias se perdiera y lo substituyera un simple de Advocatis, del cual derivarían Advocarii, Avogarii, Avogadri.
En 1789 Amedeo Avogadro se graduó en filosofía, algunos años más tarde en jurisprudencia, y en 1796 obtuvo el nombramiento oficial de doctor en ley eclesiástica, que le permitió desempeñarse en el Ufficio dei poveri y posteriormente en la Avvocatura generale.
En 1801 el gobierno de la República Francesa lo nombró secretario de la Prefectura del Departamento del Eridano. Pero en realidad lo que realmente interesaba al joven Avogadro era el campo de las ciencias, y muy particularmente los estudios de física y matemática, enriquecidos por las estimulantes innovaciones de la época. En 1800 llegó a ser discípulo del insigne físico y matemático Vassalli Eandi.
En 1806, tras un período de cinco años de estudio, fue nombrado profesor auxiliar en el Regio Collegio delle Province de Turín y pocos años después (1809), profesor de matemática y física en el Liceo o Collegio de Vercelli, donde conservó su cargo hasta 1819.
Con la creación de la Universidad de Turín, por decreto del rey Víctor Manuel I el 6 de noviembre de 1820, Avogadro asume la dirección de la primera cátedra de física sublime, que desempeñó tan sólo hasta 1821, cuando, a raíz de los movimientos revolucionarios, se suspendieron muchas cátedras universitarias, sin ninguna consideración por los méritos científicos de los respectivos docentes. En realidad, como es sabido, de este modo se deseaba castigar no tanto a las personas, como a la institución universitaria, crisol de ideas de progreso y por ende, de reflexión, es decir castigar ¡a la ciencia! El físico turinés fue designado entonces Mastro Uditore de la Cámara Real de Cuentas. En 1832 Carlo Alberto rehabilitó las cátedras universitarias suspendidas por su predecesor, y Avogadro, dados sus grandes méritos científicos, recuperó su cargo, que desempeñó desde 1834 hasta 1850, año en que cedió la docencia a su discípulo Felice Chiò.
Los biógrafos lo describen como un hombre de temple excepcional, de férrea voluntad y extraordinaria capacidad de dedicación al trabajo. Consolidaba y corroboraba su cultura científica un vasto conocimiento de las letras, la filosofía y los tratados jurídicos. Avogadro dividía su tiempo entre el estudio, la docencia y su familia, y pese al relativo deshogo que le procuraban los éxitos, llevaba un tren de vida moderado, exento de excesos y jactancia. Se encontraba siempre dispuesto a la confrontación, y manifestaba asimismo una particular sensibilidad por la formación científica de los jóvenes estudiantes que le eran encomendados.
Su amigo Felice Romani, quien le tenía en suma estima, anunciaba la muerte del químico turinés, acaecida en 1856, en lo siguientes términos: Con la bondad del corazón se correspondía en Avogadro la gentileza de su persona: ojos vivaces pero de mirada serena, dulce y expresiva fisonomía, labios elocuentes, trato cortés, modales afectuosos y sinceros; garbo y vigor en gráciles miembros. Religioso sin intolerancia, docto sin pedantería, sabio sin ostentación, enemigo del fasto, despreocupado por la riqueza, sin ambición a los honores, desconocedor de sus méritos y reputación, modesto, sobrio, afectuoso.La carrera científica de Avogadro se encuentra íntimamente ligada a los estudios sobre la electricidad realizados por Volta. Entre 1806 y 1807 el químico turinés publicó una memoria sobre los cuerpos aislantes, posteriormente denominados dieléctricos por Faraday. Avogadro admitió que en dichos cuerpos se generan alternadamente estados moleculares negativos y positivos que acaban volviéndolos neutros en su conjunto. Dedujo, además, que todos los fenómenos eléctricos pueden resumirse en fenómenos químicos. Algunos años más tarde se interesó por el concepto de acidez de base de las sustancias y describió los hidrácidos como ácidos sin oxígeno. Estableció la primera tabla de potenciales electroquímicos de los elementos, distribuyendo los ya conocidos en una sucesión en cuyos extremos se encontraban respectivamente los elementos más electronegativos y los más electropositivos.
Cuando en 1808 Gay-Lussac (1778-1850) enunció las leyes de combinación de los elementos en estado gaseoso (Proust [1754-1826) había publicado la ley de las proporciones definidas en 1801), Avogadro relacionó éstas con la hipótesis atómica de John Dalton (1766-1844), publicada en el New System of Chemical Philosophy (1808).
Sus reflexiones dieron por fruto una memoria publicada en 1811, titulada en francés: Essai d'une manière de déterminer les masses relatives des molécules élementaires des corps et les proportions selon lesquelles elles entrent dans ces combinaisons.
Los años comprendidos entre 1800 y 1811 fueron, sin lugar a duda, sumamente fecundos para la química y la ciencia en general. Tales progresos pudieron realizarse gracias a la obra de Lavoisier (1743-1794), quien en los últimos años del siglo XVIII había perfeccionado y completado sus estudios sobre combinación de los elementos en estado sólido, la combustión y la conservación de la masa en las reacciones químicas. (Recuérdese la publicación, en 1787 y 1789 en Francia, de los volúmenes Méthode de Nomenclature Chimique, de Lavoisier, Morveau, Berthollet, Fourcroy, y el Traité élémentaire de Chimie del mismo Lavoisier).
Particular reflexión merece la teoría atómica de Dalton, la cual aparece precisamente como una fundamental conquista conceptual de la nueva química que se estaba construyendo gradual pero rápidamente por entonces. Recuérdese que con ella renacía la antigua teoría de los griegos Demócrito y Leucipo, examinadas ahora a la luz de los nuevos descubrimientos de la física y la química de Lavoisier. En síntesis, tal teoría afirmaba que: dado que en los compuestos que forman, los diversos elementos aparecen siempre según valores de peso bien definidos, enteros y nunca fraccionarios, tales valores deben ser necesariamente múltiplos de pesos muy pequeños, pero no nulos, característicos de cada uno de los elementos. Tales pesos deben por tanto corresponderse con el peso de una partícula indivisible, llamada átomo, típica de cada elemento.
La novedad conceptual de esta teoría radica en admitir que todos los elementos están constituidos por átomos indivisibles, de diferentes pesos, y que las reacciones químicas se producen por simple combinación de partículas elementales de elementos diferentes. Por consiguiente, según Dalton, un átomo de hidrógeno reacciona con un átomo de oxígeno para dar una molécula de agua; un átomo de nitrógeno con uno de hidrógeno para dar una molécula de amoníaco. Estos simples ejemplos dejan translucir la dificultad de Dalton en establecer las precisas relaciones combinatorias entre los elementos en estado gaseoso que participaban en las reacciones anteriormente descritas.
El problema fue resuelto por dos experimentadores de gran talento: el ya mencionado Joseph Louis Gay-Lussac, profesor de física y química en la Universidad de la Sorbona de París, y el naturalista y geógrafo alemán Alexander von Humboldt (1769-1859). El geógrafo alemán, por aquellos primeros años del siglo XIX, se interesaba por la composición del aire y del agua. Le interesaba muy particularmente determinar las exactas proporciones de oxígeno e hidrógeno presentes en el líquido elemento. En sus experimentos había utilizado el método de la combustión del hidrógeno con el oxígeno sugerido po Volta, pero los resultados obtenidos eran contradictorios. Decidió entonces recurrir a Gay-Lussac para proponerle encarar juntos el problema. El resultato de sus estudios conjuntos fue una memoria publicada en 1805, en la que ambos estudiosos demostraron que la relación combinatoria entre los dos gases, en la formación de la molécula de agua, era de 2 volúmenes de hidrógeno u 1 volumen de oxígeno, y que estos tres volúmenes de gas daban 2 volúmenes de vapor de agua. Semejante resultado fue importante, no sólo como brillante conquista experimental, sino principalmente porque suscitaba grandes divergencias entre los químicos de la época, una profunda disonancia respecto de todo el aparato teórico construido hasta entonces.
Tal como veremos a continuación, partiendo de estos datos experimentales, aparentemente contradictorios, (¿cómo habrían podido tres volúmenes de gas reactivos dar tan sólo dos volúmenes de gas producidos?), Avogadro consiguió formular su brillante hipótesis.
La gran simplicidad de las relaciones combinatorias impulsó a Gay-Lussac a continuar solo sus experimentos, utilizando otros gases y determinando las respectivas relaciones combinatorias (entre un volumen de cloro y uno de hidrógeno para dar dos volúmenes di ácido clorhídrico; entre dos volúmenes de nitrógeno y uno de oxígeno para dar dos volúmenes de protóxido de nitrógeno, etc.). Los resultados de sus estudios fueron recogidos, como ya hemos dicho, en la publicación de 1808, titulada: Sur les combinaisons des substances gazeuses les unes avec les autres.
Sin embargo, la teoría daltoniana de los átomos indivisibles no podía concordar con los resultados de Gay-Lussac. Las relaciones simples de los volúmenes de combinación no se explicaban si se admitía que los elementos gaseosos sólo podían encontrarse en estado atómico. Por otra parte, la teoría del químico inglés había encontrado en Jons Jacob Berzelius (1779-1848) un tenaz sostenedor. En una publicación de 1812, Berzelius, inspirándose en los estudios de A. Volta, afirmó que no podían existir moléculas de elementos gaseosos, como el hidrógeno, el oxígeno o el nitrógeno, por cuanto los átomos se agregaban siguiendo las leyes de la electroestática, es decir comportándose algunos como positivos y otros, como negativos. La tenaz oposición ante la teoría atómica del químico sueco Berzelius, que gozaba de indiscutida autoridad en la comunidad científica internacional, fue la principal causa de la conjura de silencio que tuvo lugar en menoscabo de Amedeo Avogadro.
Particular reflexión merece la teoría atómica de Dalton, la cual aparece precisamente como una fundamental conquista conceptual de la nueva química que se estaba construyendo gradual pero rápidamente por entonces. Recuérdese que con ella renacía la antigua teoría de los griegos Demócrito y Leucipo, examinadas ahora a la luz de los nuevos descubrimientos de la física y la química de Lavoisier. En síntesis, tal teoría afirmaba que: dado que en los compuestos que forman, los diversos elementos aparecen siempre según valores de peso bien definidos, enteros y nunca fraccionarios, tales valores deben ser necesariamente múltiplos de pesos muy pequeños, pero no nulos, característicos de cada uno de los elementos. Tales pesos deben por tanto corresponderse con el peso de una partícula indivisible, llamada átomo, típica de cada elemento.
La novedad conceptual de esta teoría radica en admitir que todos los elementos están constituidos por átomos indivisibles, de diferentes pesos, y que las reacciones químicas se producen por simple combinación de partículas elementales de elementos diferentes. Por consiguiente, según Dalton, un átomo de hidrógeno reacciona con un átomo de oxígeno para dar una molécula de agua; un átomo de nitrógeno con uno de hidrógeno para dar una molécula de amoníaco. Estos simples ejemplos dejan translucir la dificultad de Dalton en establecer las precisas relaciones combinatorias entre los elementos en estado gaseoso que participaban en las reacciones anteriormente descritas.
El problema fue resuelto por dos experimentadores de gran talento: el ya mencionado Joseph Louis Gay-Lussac, profesor de física y química en la Universidad de la Sorbona de París, y el naturalista y geógrafo alemán Alexander von Humboldt (1769-1859). El geógrafo alemán, por aquellos primeros años del siglo XIX, se interesaba por la composición del aire y del agua. Le interesaba muy particularmente determinar las exactas proporciones de oxígeno e hidrógeno presentes en el líquido elemento. En sus experimentos había utilizado el método de la combustión del hidrógeno con el oxígeno sugerido po Volta, pero los resultados obtenidos eran contradictorios. Decidió entonces recurrir a Gay-Lussac para proponerle encarar juntos el problema. El resultato de sus estudios conjuntos fue una memoria publicada en 1805, en la que ambos estudiosos demostraron que la relación combinatoria entre los dos gases, en la formación de la molécula de agua, era de 2 volúmenes de hidrógeno u 1 volumen de oxígeno, y que estos tres volúmenes de gas daban 2 volúmenes de vapor de agua. Semejante resultado fue importante, no sólo como brillante conquista experimental, sino principalmente porque suscitaba grandes divergencias entre los químicos de la época, una profunda disonancia respecto de todo el aparato teórico construido hasta entonces.
Tal como veremos a continuación, partiendo de estos datos experimentales, aparentemente contradictorios, (¿cómo habrían podido tres volúmenes de gas reactivos dar tan sólo dos volúmenes de gas producidos?), Avogadro consiguió formular su brillante hipótesis.
La gran simplicidad de las relaciones combinatorias impulsó a Gay-Lussac a continuar solo sus experimentos, utilizando otros gases y determinando las respectivas relaciones combinatorias (entre un volumen de cloro y uno de hidrógeno para dar dos volúmenes di ácido clorhídrico; entre dos volúmenes de nitrógeno y uno de oxígeno para dar dos volúmenes de protóxido de nitrógeno, etc.). Los resultados de sus estudios fueron recogidos, como ya hemos dicho, en la publicación de 1808, titulada: Sur les combinaisons des substances gazeuses les unes avec les autres.
Sin embargo, la teoría daltoniana de los átomos indivisibles no podía concordar con los resultados de Gay-Lussac. Las relaciones simples de los volúmenes de combinación no se explicaban si se admitía que los elementos gaseosos sólo podían encontrarse en estado atómico. Por otra parte, la teoría del químico inglés había encontrado en Jons Jacob Berzelius (1779-1848) un tenaz sostenedor. En una publicación de 1812, Berzelius, inspirándose en los estudios de A. Volta, afirmó que no podían existir moléculas de elementos gaseosos, como el hidrógeno, el oxígeno o el nitrógeno, por cuanto los átomos se agregaban siguiendo las leyes de la electroestática, es decir comportándose algunos como positivos y otros, como negativos. La tenaz oposición ante la teoría atómica del químico sueco Berzelius, que gozaba de indiscutida autoridad en la comunidad científica internacional, fue la principal causa de la conjura de silencio que tuvo lugar en menoscabo de Amedeo Avogadro.
EJEMPLO DE LA ECUACIÓN DE LAS LEYES COMBINADAS DE LOS GASES
Una muestra de Neón ocupa 105L a 27ºC bajo una presión de 985torr.
¿Qué volumen ocuparía a temperatura y presión normal (PTN)?
V1 = 105L P1 =985torr T1 =27ºC+273º =300ºK
V2 = ? P2 =760torr T2 =273ºK
Resolviendo para V2
Una muestra de Neón ocupa 105L a 27ºC bajo una presión de 985torr.
¿Qué volumen ocuparía a temperatura y presión normal (PTN)?
V1 = 105L P1 =985torr T1 =27ºC+273º =300ºK
V2 = ? P2 =760torr T2 =273ºK
Resolviendo para V2
EJERCICIOS DE APLICACIÓN DE LA ECUACIÓN DE LAS LEYES COOMBINADAS DE LOS GASES
· Una muestra de gas ocupa 400mL a PTN. ¿Bajo qué presión ocuparía ésta muestra 200mL si la temperatura se incrementara a 819ºC?
· Una muestra de hidrógeno ocupa 375mL a PTN. Si la temperatura fuese incrementada 773ºC, ¿qué presión final sería necesaria para mantener el volumen constante a 375mL?
· Una muestra de 247mL de un gas ejerce una presión de 3,33atm a 16ºC. ¿Qué volumen ocuparía a 100ºC y 1,00 atm?
· Una muestra de 280mL de neón ejerce una presión de 660torr a 26ºC. ¿A qué temperatura en ºC ejercería una presión de 880torr con un volumen de 440mL¿Qué temperatura sería necesaria para duplicar el volumen de un gas ideal a PTN si la presión desciende en un 25%?
· Una muestra de gas ocupa 400mL a PTN. ¿Bajo qué presión ocuparía ésta muestra 200mL si la temperatura se incrementara a 819ºC?
· Una muestra de hidrógeno ocupa 375mL a PTN. Si la temperatura fuese incrementada 773ºC, ¿qué presión final sería necesaria para mantener el volumen constante a 375mL?
· Una muestra de 247mL de un gas ejerce una presión de 3,33atm a 16ºC. ¿Qué volumen ocuparía a 100ºC y 1,00 atm?
· Una muestra de 280mL de neón ejerce una presión de 660torr a 26ºC. ¿A qué temperatura en ºC ejercería una presión de 880torr con un volumen de 440mL¿Qué temperatura sería necesaria para duplicar el volumen de un gas ideal a PTN si la presión desciende en un 25%?
La ley de Avogadro y el volumen molar normal
La ley de Gay-Lussac no tenía una interpretación adecuada en base a los postulados de la teoría atómica de Dalton. Para John Dalton y sus seguidores, las partículas que forman los elementos eran los átomos y según su hipotesis de máxima simplicidad si dos elementos forman un sólo compuesto, éste tendrá un átomo de cada elemento. Así, para el agua suponía una fórmula HO. Según esto, un volumen de hidrógeno reacciona con un volumen de oxígeno para dar dos volúmenes de agua, en contra de los datos experimentales.
No fue hasta 1814 cuando Avogadro admitió la existencia de moléculas formadas por dos o más átomos. Según Avogadro, en una reacción química una molécula de reactivo debe reaccionar con una o varias moléculas de otro reactivo, dando lugar a una o varias moléculas del producto, pero una molécula no puede reaccionar con un número no entero de moléculas, ya que la unidad mínima de un reactivo es la molécula. Debe existir, por tanto, una relación de números enteros sencillos entre las moléculas de los reactivos, y entre éstas moléculas y las del producto.
No fue hasta 1814 cuando Avogadro admitió la existencia de moléculas formadas por dos o más átomos. Según Avogadro, en una reacción química una molécula de reactivo debe reaccionar con una o varias moléculas de otro reactivo, dando lugar a una o varias moléculas del producto, pero una molécula no puede reaccionar con un número no entero de moléculas, ya que la unidad mínima de un reactivo es la molécula. Debe existir, por tanto, una relación de números enteros sencillos entre las moléculas de los reactivos, y entre éstas moléculas y las del producto.
Según la ley de Gay-Lussac esta misma relación es la que ocurre entre los volúmenes de los gases en una reacción química. Por ello, debe de existir una relación directa entre éstos volúmenes de gases y el número de moléculas que contienen.
La ley de Avogadro dice que:
"Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas"
También el enunciado inverso es cierto: "Un determinado número de moléculas de dos gases diferentes ocupan el mismo volumen en idénticas condiciones de presión y temperatura".
Esta ley suele enunciarse actualmente también como: "La masa atómica o átomo-gramo de diferentes elementos contienen el mismo número de átomos".
Tal como se mencionó el estudio de los gases atrajo la atención del físico italiano Amadeo Avogadro, que en 1811 formuló una importante ley que lleva su nombre. Esta ley afirma que dos volúmenes iguales de gases diferentes contienen el mismo número de moléculas si sus condiciones de temperatura y presión son las mismas. Si se dan esas condiciones, dos botellas idénticas, una llena de oxígeno y otra de helio, contendrán exactamente el mismo número de moléculas. Sin embargo, el número de átomos de oxígeno será dos veces mayor puesto que el oxígeno es diatómico.
De la ley de Avogadro se desprende que las masas de un volumen patrón de diferentes gases (es decir, sus densidades) son proporcionales a la masa de cada molécula individual de gas.
Si se toma el átomo de carbono como patrón y se le asigna un valor de 12,0000 unidades de masa atómica (u), esto quiere decir que el átomo de carbono tiene una masa de 12. A partir de esto nosotros podemos determinar la masa atómica de otros elementos de la tabla periódica, como el hidrógeno. Así, el hidrógeno tiene una masa atómica de 1,0079 u; el helio, de 4,0026 u; el flúor, de 18,9984 u, y el sodio, de 22,9898 u.
La observación de que muchas masas atómicas se aproximan a números enteros llevó al químico británico William Prout a sugerir, en 1816, que todos los elementos podrían estar compuestos por átomos de hidrógeno. No obstante, medidas posteriores de las masas atómicas demostraron que el cloro, por ejemplo, tiene una masa atómica de 35,453 (si se asigna al carbono el valor 12).
Muchas veces se habla de “peso atómico”, pero lo correcto es “masa atómica”. La masa es una propiedad del cuerpo, mientras que el peso es la fuerza ejercida sobre el cuerpo a causa de la gravedad.
El descubrimiento de estas masas atómicas fraccionarias pareció invalidar la hipótesis de Prout hasta un siglo después, cuando se descubrió que, por lo general, los átomos de un elemento dado no tienen todos la misma masa.
En resumen se tienen que a temperatura y presión constante, el volumen ocupado por una muestra de gas es directamente proporcional al número de moles de gas
V α n o V = kn (P,T constantes)
Para muestras diferentes de gas a la misma temperatura y presión, la relación entre los volúmenes y número de moles se puede representar como :
La ley de Avogadro dice que:
"Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas"
También el enunciado inverso es cierto: "Un determinado número de moléculas de dos gases diferentes ocupan el mismo volumen en idénticas condiciones de presión y temperatura".
Esta ley suele enunciarse actualmente también como: "La masa atómica o átomo-gramo de diferentes elementos contienen el mismo número de átomos".
Tal como se mencionó el estudio de los gases atrajo la atención del físico italiano Amadeo Avogadro, que en 1811 formuló una importante ley que lleva su nombre. Esta ley afirma que dos volúmenes iguales de gases diferentes contienen el mismo número de moléculas si sus condiciones de temperatura y presión son las mismas. Si se dan esas condiciones, dos botellas idénticas, una llena de oxígeno y otra de helio, contendrán exactamente el mismo número de moléculas. Sin embargo, el número de átomos de oxígeno será dos veces mayor puesto que el oxígeno es diatómico.
De la ley de Avogadro se desprende que las masas de un volumen patrón de diferentes gases (es decir, sus densidades) son proporcionales a la masa de cada molécula individual de gas.
Si se toma el átomo de carbono como patrón y se le asigna un valor de 12,0000 unidades de masa atómica (u), esto quiere decir que el átomo de carbono tiene una masa de 12. A partir de esto nosotros podemos determinar la masa atómica de otros elementos de la tabla periódica, como el hidrógeno. Así, el hidrógeno tiene una masa atómica de 1,0079 u; el helio, de 4,0026 u; el flúor, de 18,9984 u, y el sodio, de 22,9898 u.
La observación de que muchas masas atómicas se aproximan a números enteros llevó al químico británico William Prout a sugerir, en 1816, que todos los elementos podrían estar compuestos por átomos de hidrógeno. No obstante, medidas posteriores de las masas atómicas demostraron que el cloro, por ejemplo, tiene una masa atómica de 35,453 (si se asigna al carbono el valor 12).
Muchas veces se habla de “peso atómico”, pero lo correcto es “masa atómica”. La masa es una propiedad del cuerpo, mientras que el peso es la fuerza ejercida sobre el cuerpo a causa de la gravedad.
El descubrimiento de estas masas atómicas fraccionarias pareció invalidar la hipótesis de Prout hasta un siglo después, cuando se descubrió que, por lo general, los átomos de un elemento dado no tienen todos la misma masa.
En resumen se tienen que a temperatura y presión constante, el volumen ocupado por una muestra de gas es directamente proporcional al número de moles de gas
V α n o V = kn (P,T constantes)
Para muestras diferentes de gas a la misma temperatura y presión, la relación entre los volúmenes y número de moles se puede representar como :
EJEMPLO DE LA LEY DE AVOGADRO
Un mol de gas ocupa 27,0L, y su densidad es 1,41g/L a una temperatura y presión particular. ¿Cuál es su peso molecular? ¿Cuál es la densidad del gas a PTN?
Un mol de gas ocupa 27,0L, y su densidad es 1,41g/L a una temperatura y presión particular. ¿Cuál es su peso molecular? ¿Cuál es la densidad del gas a PTN?
PTN 1,00 mol de gas, 38,1g ocuparían 22,4L, y su densidad sería
EJERCICIOS DE APLICACIÓN DE LA LEY DE AVOGADRO
· El dibromuro de etileno (DBE) se usaba hasta ahora como un fungicida para frutas y grano, pero se ha prohibido debido a que es un carcinógeno potencial. El DBE es un líquido que hierve a 109ºC. Su peso molecular es de 188g/mol. Calcula la densidad de su vapor a 180ºC y 1,00 atm.
· El límite sensibilidad para el análisis de monóxido de Carbono, CO, en el aire es de 1ppb (ppb = partes por miles de millones) en volumen. ¿Cuál es el menor número de moléculas de CO que se pueden detectar en 10L de aire a PTN)
· Un técnico de laboratorio se olvidó que significaba el código de colores de algunas bombonas comerciales de gases, pero se acordaba que una de cada dos bombonas contenía los gases siguientes: He, Ne, Ar o Kr. Medidas realizadas a PTN sobre las muestras de gases de las dos bombonas mostraron que las densidades eran 3,74g/L y 0,178g/L. Determina mediante cálculos cuáles de éstos gases estaban presentes en cada bombonaUn matraz de 503mL contiene 0,0243 moles de un gas ideal a una temperatura y presión determinadas. Otro matraz contiene 0,0188 moles de gas a la misma temperatura y presión. ¿Cuál es el volumen del segundo matraz?
Ley de Dalton de las presiones parciales
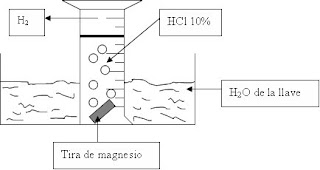
Dalton publicó en 1793 su primera obra, “Observaciones y ensayos meteorológicos”. A este libro, a pesar de su originalidad y de que contenía el embrión de sus posteriores descubrimientos, se le prestó poca atención dada la procedencia de Dalton, ajena al establishment científico de la época. En esta obra, Dalton presentaba un estudio experimental de las propiedades físicas del aire atmosférico y entre sus conclusiones afirmaba que el agua que se evapora existía en el aire como un gas independiente y que esto se podía explicar si tanto el aire como el agua estuviesen constituidas por partículas discretas, entendiendo la evaporación como un proceso de mezcla de ambos tipos de partículas. Dalton recogiendo metano para sus investigaciones sobre los gases. (Pintado entre 1878 y 1893 por Ford Brown) En el curso de esta investigación, realizó una serie de experimentos con mezclas de gases para determinar cómo afectaban las propiedades de los gases individuales a las propiedades del conjunto y descubrió la ley que se conoce como ley de Dalton de las presiones parciales, según la cual cada componente de una mezcla de gases ejerce la misma presión que si fuera el único que ocupara todo el volumen de la mezcla a igualdad de temperatura, de modo que la presión total de la mezcla es igual a la suma de las presiones de cada gas por separado si ocupara todo el volumen de la mezcla y estuviese a la misma temperatura. En 1788, estimulado por la observación de una aurora boreal, se interesó por el fenómeno y comenzó una serie de observaciones que le llevó a intuir una relación entre el fenómeno de las auroras y el magnetismo terrestre (aunque el mecanismo que conjeturó no estaba acertado), demostrando una vez más una visión preclara y un pensamiento independiente.
La pasión de Dalton por el conocimiento y la explicación de los fenómenos naturales también le llevaron a trabajar en otros terrenos científicos tan diversos como la preparación de herbarios e insectarios.
La pasión de Dalton por el conocimiento y la explicación de los fenómenos naturales también le llevaron a trabajar en otros terrenos científicos tan diversos como la preparación de herbarios e insectarios.
EJERCICIOS
· Una muestra de oxígeno de 30,0g de masa está confinada en un recipiente a 0ºC y 1,00 torr. Después se bombean 8,00g de Hidrógeno en el recipiente a temperatura constante. ¿Cuál será la presión final en el recipiente (suponiendo sólo mezcla sin reacción)
· Una mezcla de ciclopropano-oxígeno se puede usar como anestésico. Si las presiones parciales del ciclopropano y del oxígeno son 140torr y 560torr, respectivamente, ¿Cuál es la relación del número de moléculas del ciclopropano a oxígeno en ésta mezcla
· ¿Cuál es la fracción molar de cada gas en la mezcla que contiene 0,267atm de Ar y 0,277atm de Xe?
· Supón que el aire sin polucionar tiene la composición señalada en la tabla 12,2. Calcula el número de moléculas de N2, de O2 y de Ar en 1,00L de aire a 21ºC y 1,00atm y calcula las fracciones molares del N2, O2 y Ar en el aire
· Un estudio sobre escaladores que subieron a la cima del monte Everest sin oxígeno suplementario reveló que las presiones parciales de O2 y de CO2 en sus pulmones era de 35torr y 7,5torr, respectivamente. La presión barométrica en la cima era de 253torr. Supón que los gases pulmonares están saturados de humedad a la temperatura corporal de 37ºC. Calcula la presión parcial del gas inerte (fundamentalmente nitrógeno) en los pulmones de los escaladores.
· Un matraz de 6,00L que contiene He a 6,00atm se conecta con un matraz de 3,00L que contiene N2 a 3,00atm y se deja que los gases se mezclen. Halla las presiones parciales de cada gas después de que se hallan mezclado. Halla la presión total de la mezcla. ¿cuál es la fracción molar del Helio?
· Una muestra de oxígeno de 30,0g de masa está confinada en un recipiente a 0ºC y 1,00 torr. Después se bombean 8,00g de Hidrógeno en el recipiente a temperatura constante. ¿Cuál será la presión final en el recipiente (suponiendo sólo mezcla sin reacción)
· Una mezcla de ciclopropano-oxígeno se puede usar como anestésico. Si las presiones parciales del ciclopropano y del oxígeno son 140torr y 560torr, respectivamente, ¿Cuál es la relación del número de moléculas del ciclopropano a oxígeno en ésta mezcla
· ¿Cuál es la fracción molar de cada gas en la mezcla que contiene 0,267atm de Ar y 0,277atm de Xe?
· Supón que el aire sin polucionar tiene la composición señalada en la tabla 12,2. Calcula el número de moléculas de N2, de O2 y de Ar en 1,00L de aire a 21ºC y 1,00atm y calcula las fracciones molares del N2, O2 y Ar en el aire
· Un estudio sobre escaladores que subieron a la cima del monte Everest sin oxígeno suplementario reveló que las presiones parciales de O2 y de CO2 en sus pulmones era de 35torr y 7,5torr, respectivamente. La presión barométrica en la cima era de 253torr. Supón que los gases pulmonares están saturados de humedad a la temperatura corporal de 37ºC. Calcula la presión parcial del gas inerte (fundamentalmente nitrógeno) en los pulmones de los escaladores.
· Un matraz de 6,00L que contiene He a 6,00atm se conecta con un matraz de 3,00L que contiene N2 a 3,00atm y se deja que los gases se mezclen. Halla las presiones parciales de cada gas después de que se hallan mezclado. Halla la presión total de la mezcla. ¿cuál es la fracción molar del Helio?
BIOGRAFÍA DE DALTON
John Dalton nació en Eaglesfield (Inglaterra) el 6 de septiembre de 1766, en el seno de una humilde familia cuáquera1. Su padre era tejedor y su madre una campesina. John recibió su educación primaria de la mano de su propio padre y de John Fletcher, el maestro de la escuela cuáquera de Eaglesfield. También Elihu Robinson, un adinerado cuáquero, apasionado de la meteorología y que se fabricaba sus propios instrumentos, se convirtió en el mentor de Dalton y fue una rica fuente de estimulación mental para el muchacho en matemáticas y ciencia, especialmente en meteorología. La jubilación de Fletcher en 1778, cuando Dalton contaba con tan solo 12 años, convirtió a este último en un prematuro maestro de escuela. Aunque
sus mentores le habían proporcionado una sólida base de conocimientos y una gran pasión por la búsqueda del saber, transcurridos dos años lo precario del salario le obligó a abandonar el puesto y regresar al trabajo en el campo. Unos años después, en 1781, Dalton marchó a Kendal junto con su hermano Jonathan donde trabajaron durante 12 años como maestros ayudantes en la escuela de su primo George Bewley. Aunque hacia 1790 parece que barajó la posibilidad de dedicarse al estudio de leyes o medicina, no fue apoyado por su familia y finalmente, se marchó a Manchester donde fue contratado como profesor de matemáticas y filosofía natural (ciencias naturales) en el New College, un centro creado por los presbiterianos para dar educación primaria a futuros alumnos de Oxford y Cambridge. Allí pasó el resto de su vida ejerciendo como profesor y más tarde también como tutor privado, enseñando matemáticas y física para sufragar sus experimentos.
Dalton poseía una gran iniciativa y tenacidad y a pesar de ser “un experimentador algo tosco” (como le llamo Davy) poseía sin embargo una visión preclara para la elaboración de modelos teóricos que permitiesen explicar los hechos experimentales. Resulta difícil de creer que a pesar de disponer de materiales de laboratorio caseros y más bien rudos, que proporcionaban datos no demasiado precisos, mediante sus experimentos y observaciones Dalton obtenía la suficiente información para poder vislumbrar las pistas que le conducían hacia las respuestas correctas, lo cual sólo puede interpretarse desde una mente visionaria y una intuición prodigiosa. Durante su estancia en Kendal, Dalton encontró un
nuevo amigo y mentor en la persona de John Gough, el hijo ciego de un rico hombre de negocios que le enseñó idiomas, matemáticas, óptica y compartió con él su nutrida y extensa biblioteca. Gough fue el que le estimuló sugiriéndole que mantuviese un cuaderno diario de anotaciones sobre sus observaciones meteorológicas. De este modo, en 1787 Dalton comenzó una serie de estudios meteorológicos que continuó durante 57 años, acumulando un total de 200.000 observaciones y medidas. La pasión de Dalton por la meteorología le llevó a estudiar un gran número de fenómenos y a desarrollar y perfeccionar la instrumentación necesaria para realizar sus mediciones diarias de temperatura, presión atmosférica y pluviometría, siendo el primero en demostrar que la lluvia se produce por un descenso de temperatura y no por un cambio de la presión atmosférica.
En 1794 fue elegido miembro de la Sociedad Literaria y Filosófica de Manchester y tras unas pocas semanas presentó un estudio titulado “Hechos extraordinarios relativos a la visión de los colores”, que es la primera constatación científica acerca de la enfermedad conocida como daltonismo o ceguera a los colores y que padecían tanto el propio Dalton como su hermano. Especuló con la posibilidad de que este defecto fuese causado por una coloración anormal del medio líquido presente en el globo ocular, lo que conjeturó como “coloración azulada del humor acuoso”. Cuando Dalton murió y por mandato expreso, sus ojos fueron examinados en un intento de confirmar su teoría El examen posmortem mostró un color del humor acuoso totalmente normal. Sin embargo, se preservó un ojo en la Royal Society y en 1990 se le practicó un análisis del DNA, confirmando que no podía fabricar el pigmento que da al ojo humano la sensibilidad hacia el color verde.
sus mentores le habían proporcionado una sólida base de conocimientos y una gran pasión por la búsqueda del saber, transcurridos dos años lo precario del salario le obligó a abandonar el puesto y regresar al trabajo en el campo. Unos años después, en 1781, Dalton marchó a Kendal junto con su hermano Jonathan donde trabajaron durante 12 años como maestros ayudantes en la escuela de su primo George Bewley. Aunque hacia 1790 parece que barajó la posibilidad de dedicarse al estudio de leyes o medicina, no fue apoyado por su familia y finalmente, se marchó a Manchester donde fue contratado como profesor de matemáticas y filosofía natural (ciencias naturales) en el New College, un centro creado por los presbiterianos para dar educación primaria a futuros alumnos de Oxford y Cambridge. Allí pasó el resto de su vida ejerciendo como profesor y más tarde también como tutor privado, enseñando matemáticas y física para sufragar sus experimentos.
Dalton poseía una gran iniciativa y tenacidad y a pesar de ser “un experimentador algo tosco” (como le llamo Davy) poseía sin embargo una visión preclara para la elaboración de modelos teóricos que permitiesen explicar los hechos experimentales. Resulta difícil de creer que a pesar de disponer de materiales de laboratorio caseros y más bien rudos, que proporcionaban datos no demasiado precisos, mediante sus experimentos y observaciones Dalton obtenía la suficiente información para poder vislumbrar las pistas que le conducían hacia las respuestas correctas, lo cual sólo puede interpretarse desde una mente visionaria y una intuición prodigiosa. Durante su estancia en Kendal, Dalton encontró un
nuevo amigo y mentor en la persona de John Gough, el hijo ciego de un rico hombre de negocios que le enseñó idiomas, matemáticas, óptica y compartió con él su nutrida y extensa biblioteca. Gough fue el que le estimuló sugiriéndole que mantuviese un cuaderno diario de anotaciones sobre sus observaciones meteorológicas. De este modo, en 1787 Dalton comenzó una serie de estudios meteorológicos que continuó durante 57 años, acumulando un total de 200.000 observaciones y medidas. La pasión de Dalton por la meteorología le llevó a estudiar un gran número de fenómenos y a desarrollar y perfeccionar la instrumentación necesaria para realizar sus mediciones diarias de temperatura, presión atmosférica y pluviometría, siendo el primero en demostrar que la lluvia se produce por un descenso de temperatura y no por un cambio de la presión atmosférica.
En 1794 fue elegido miembro de la Sociedad Literaria y Filosófica de Manchester y tras unas pocas semanas presentó un estudio titulado “Hechos extraordinarios relativos a la visión de los colores”, que es la primera constatación científica acerca de la enfermedad conocida como daltonismo o ceguera a los colores y que padecían tanto el propio Dalton como su hermano. Especuló con la posibilidad de que este defecto fuese causado por una coloración anormal del medio líquido presente en el globo ocular, lo que conjeturó como “coloración azulada del humor acuoso”. Cuando Dalton murió y por mandato expreso, sus ojos fueron examinados en un intento de confirmar su teoría El examen posmortem mostró un color del humor acuoso totalmente normal. Sin embargo, se preservó un ojo en la Royal Society y en 1990 se le practicó un análisis del DNA, confirmando que no podía fabricar el pigmento que da al ojo humano la sensibilidad hacia el color verde.
Teoría atómica de Dalton
Y volvemos a la química. El interés que Dalton sentía por las propiedades y la estructura física de los gases, unido a su capacidad para la elaboración de modelos teóricos, le llevo a realizar la más importante de sus contribuciones a la ciencia, su Teoría Atómica. Para explicar la homogeneidad y el comportamiento de las mezclas gaseosas que
estudiaba y coincidiendo con las especulaciones de Boyle y Newton en que los gases deben estar constituidos por partículas, Dalton elaboró la teoría atómica que lleva su nombre, piedra angular de la Química Moderna.
Para poder calibrar la importancia de la teoría atómica de Dalton, debemos recordar que cuatro siglos a. de C., Demócrito y Leucipo habían introducido el concepto filosófico de átomo para expresar su creencia acerca de la discontinuidad de la materia. Afirmaban que la materia se podía dividir indefinidamente en partículas cada vez más pequeñas hasta obtener unas diminutas e indivisibles, a las que Demócrito llamó átomos. Tras más de dos mil años de creencias y conjeturas, con escasa o nula base experimental, no fue hasta el s. XVIII, después de que se produjo el descubrimiento y estudio de los diferentes gases (que constituyen la forma más sencilla de la materia), cuando los estudios empíricos desarrollados permitieron poner de manifiesto una serie de hechos experimentales que siempre se obtenían mediante manipulaciones reproducibles y mediciones precisas, al estudiar las sustancias puras, independientemente de su origen.
Los hechos experimentales condujeron a la formulación de leyes conocidas como “leyes ponderales”, todas ellas enunciadas gracias al empleo sistemático y riguroso balanzas y otros instrumentos de gran precisión para la época. Haremos un breve repaso: Ley de la conservación de la masa (LCM). 1773. Antoine Laurent Lavoisier. “Cuando ocurre una reacción química, la masa de los cuerpos reaccionantes es igual a la masa de los productos de reacción” Cuando se pesaban los reactivos, siempre se cumplíaque tenían la misma masa que los productos de reacción. Ley de las proporciones constantes (o definidas) (LPC). 1788. Joseph Louis Proust. “Cuando dos elementos se combinan para originar un determinado compuesto, siempre lo hacen en la misma proporción en peso, independientemente del origen de dicho compuesto”
Y volvemos a la química. El interés que Dalton sentía por las propiedades y la estructura física de los gases, unido a su capacidad para la elaboración de modelos teóricos, le llevo a realizar la más importante de sus contribuciones a la ciencia, su Teoría Atómica. Para explicar la homogeneidad y el comportamiento de las mezclas gaseosas que
estudiaba y coincidiendo con las especulaciones de Boyle y Newton en que los gases deben estar constituidos por partículas, Dalton elaboró la teoría atómica que lleva su nombre, piedra angular de la Química Moderna.
Para poder calibrar la importancia de la teoría atómica de Dalton, debemos recordar que cuatro siglos a. de C., Demócrito y Leucipo habían introducido el concepto filosófico de átomo para expresar su creencia acerca de la discontinuidad de la materia. Afirmaban que la materia se podía dividir indefinidamente en partículas cada vez más pequeñas hasta obtener unas diminutas e indivisibles, a las que Demócrito llamó átomos. Tras más de dos mil años de creencias y conjeturas, con escasa o nula base experimental, no fue hasta el s. XVIII, después de que se produjo el descubrimiento y estudio de los diferentes gases (que constituyen la forma más sencilla de la materia), cuando los estudios empíricos desarrollados permitieron poner de manifiesto una serie de hechos experimentales que siempre se obtenían mediante manipulaciones reproducibles y mediciones precisas, al estudiar las sustancias puras, independientemente de su origen.
Los hechos experimentales condujeron a la formulación de leyes conocidas como “leyes ponderales”, todas ellas enunciadas gracias al empleo sistemático y riguroso balanzas y otros instrumentos de gran precisión para la época. Haremos un breve repaso: Ley de la conservación de la masa (LCM). 1773. Antoine Laurent Lavoisier. “Cuando ocurre una reacción química, la masa de los cuerpos reaccionantes es igual a la masa de los productos de reacción” Cuando se pesaban los reactivos, siempre se cumplíaque tenían la misma masa que los productos de reacción. Ley de las proporciones constantes (o definidas) (LPC). 1788. Joseph Louis Proust. “Cuando dos elementos se combinan para originar un determinado compuesto, siempre lo hacen en la misma proporción en peso, independientemente del origen de dicho compuesto”
LEY DE GASES IDEALES
Al tomar como base las leyes de Boyle-Mariotte, de Charles y el principio de Avogadro, se tiene que:
V α 1 (T y n constantes) Ley de Boyle-Mariotte
P
V α T (P y n constantes) Ley de Charles
V α n (T y P constantes) Principio de Avogadro
Combinando estas tres proporcionalidades se obtiene que el volumen varía en forma directamente proporcional a la cantidad de sustancia y a la temperatura absoluta, e inversamente proporcional a la presión aplicada.
V α nT
P
Para utilizar esta proporcionalidad como una ecuación matemática, es necesario introducir una constante de proporcionalidad que en este caso es (R), y que recibe el nombre de constante universal de los gases
V = nRT _
P
PV = nRT
Esta expresión se llama: Ecuación de estado del gas ideal, o ecuación de gases ideales
Para determinar el valor de la constante universal de los gases (R) y poderlo usar en la resolución de problemas, se toma la cantidad de sustancia de 1 mol en condiciones normales de presión y temperatura, el cual ocupa un volumen de 22.4 litros.
n = 1mol De la ecuación de estado
P = 1atm PV = nRT
T = 273 °K
despejar R
V = 22.4 L nRT = PV
R = PV
nT
R = (1atm) (22.4 L)
(1mol) (273°K)
R = 0.082051282
R @ 0.082 atm L
mol °K
Notar que la tercera cifra decimal es significativa y al resolver problemas trabajar al menos tres decimales.
V α 1 (T y n constantes) Ley de Boyle-Mariotte
P
V α T (P y n constantes) Ley de Charles
V α n (T y P constantes) Principio de Avogadro
Combinando estas tres proporcionalidades se obtiene que el volumen varía en forma directamente proporcional a la cantidad de sustancia y a la temperatura absoluta, e inversamente proporcional a la presión aplicada.
V α nT
P
Para utilizar esta proporcionalidad como una ecuación matemática, es necesario introducir una constante de proporcionalidad que en este caso es (R), y que recibe el nombre de constante universal de los gases
V = nRT _
P
PV = nRT
Esta expresión se llama: Ecuación de estado del gas ideal, o ecuación de gases ideales
Para determinar el valor de la constante universal de los gases (R) y poderlo usar en la resolución de problemas, se toma la cantidad de sustancia de 1 mol en condiciones normales de presión y temperatura, el cual ocupa un volumen de 22.4 litros.
n = 1mol De la ecuación de estado
P = 1atm PV = nRT
T = 273 °K
despejar R
V = 22.4 L nRT = PV
R = PV
nT
R = (1atm) (22.4 L)
(1mol) (273°K)
R = 0.082051282
R @ 0.082 atm L
mol °K
Notar que la tercera cifra decimal es significativa y al resolver problemas trabajar al menos tres decimales.
EJEMPLO
Se hace reaccionar una tira de magnesio de 0.0252g con ácido clorhídrico diluido al 10%, contenido en una probeta invertida en el seno del agua de un cristalizador. Al terminar la reacción
Mg (s) + 2HCl (aq) MgCl2 (aq) + H2(g)
Se lee en la escala de la probeta que el magnesio desplazó 35mL de hidrógeno (H2). Calcular la masa en gramos correspondiente al volumen obtenido, si la temperatura es de 26 °C y la presión barométrica es de 601 mmHg. (Véase figura).
Se hace reaccionar una tira de magnesio de 0.0252g con ácido clorhídrico diluido al 10%, contenido en una probeta invertida en el seno del agua de un cristalizador. Al terminar la reacción
Mg (s) + 2HCl (aq) MgCl2 (aq) + H2(g)
Se lee en la escala de la probeta que el magnesio desplazó 35mL de hidrógeno (H2). Calcular la masa en gramos correspondiente al volumen obtenido, si la temperatura es de 26 °C y la presión barométrica es de 601 mmHg. (Véase figura).
Para corregir la presión, se resta el valor de la presión de vapor del agua a la misma temperatura (26 °C), tomada de la tabla correspondiente:
601 mmHg – 2502 mmHg = 575.8 mmHg
DATOS
VH2 =35 mL x 1L _ = 0.035L
1000ml
P = 575.8 mmHg x 1atm _ = 0.7576 atm
760 mmHg
T = 26°C + 273 = 299 °K
PM H2= 1.008 +1.008 = 2.016 g/mol
R = 0.082 atm L _
mol °K
En la ecuación de estado: PV = nRT
Sustituyo la cantidad de sustancia (n) por su igual
n = m _ donde: PV = m R T
PM n = numero de moles (mol) PM
m = masa (g)
PM = peso molecular (g/mol)
Ahora despejo la masa:
m _ RT = PV
PM
m = P V PM
RT
m = (0.7576 atm) (0.035 L) (2.016 g) (mol g)
(0.082 atmL) (299°K) mol
m = 0.0021802 g
m = 2.1802 x 10-3 g
601 mmHg – 2502 mmHg = 575.8 mmHg
DATOS
VH2 =35 mL x 1L _ = 0.035L
1000ml
P = 575.8 mmHg x 1atm _ = 0.7576 atm
760 mmHg
T = 26°C + 273 = 299 °K
PM H2= 1.008 +1.008 = 2.016 g/mol
R = 0.082 atm L _
mol °K
En la ecuación de estado: PV = nRT
Sustituyo la cantidad de sustancia (n) por su igual
n = m _ donde: PV = m R T
PM n = numero de moles (mol) PM
m = masa (g)
PM = peso molecular (g/mol)
Ahora despejo la masa:
m _ RT = PV
PM
m = P V PM
RT
m = (0.7576 atm) (0.035 L) (2.016 g) (mol g)
(0.082 atmL) (299°K) mol
m = 0.0021802 g
m = 2.1802 x 10-3 g
EJERCICIOS
· Un químico se está preparando para llevar a cabo una reacción a presión elevada que requiere 36, moles de hidrógeno gas. El químico bombea el hidrógeno en un recipiente rígido de acero de 12,3L a 25ºC. ¿A qué presión (en atmósferas) debe comprimirse el hidrógeno? ¿Cuál sería la densidad del hidrógeno confinado a presión elevada?
· Una muestra de neon de 5,00 moles se confina en un recipiente de 3,14L. ¿Cuál es la temperatura si la presión es de 2atm?, ¿Cuál es la densidad de la muestra?
· Cuántas moléculas gaseosas hay en un recipiente de 1,00L si la presión es de 2,5x10-9torr y la temperatura es de 1,225ºK)Una barcaza que contiene 580 toneladas de cloro líquido estuvo implicada en un accidente. ¿Qué volumen ocuparía esta cantidad de cloro si todo él se convierte en gas a 750 torr y 18ºC?. Supón que el cloro está confinado en un ancho de 0,50 millas y una profundidad aproximada de 60 pies. ¿Cuál sería la longitud, en pies, de esta <
LA TEORÍA CINÉTICO MOLECULAR
Con la llegada de la teoría atómica de la materia, las leyes empíricas antes mencionadas obtuvieron una base microscópica. El volumen de un gas refleja simplemente la distribución de posiciones de las moléculas que lo componen. Más exactamente, la variable macroscópica V representa el espacio disponible para el movimiento de una molécula. La presión de un gas, que puede medirse con manómetros situados en las paredes del recipiente, registra el cambio medio de momento lineal que experimentan las moléculas al chocar contra las paredes y rebotar en ellas. La temperatura del gas es proporcional a la energía cinética media de las moléculas, por lo que depende del cuadrado de su velocidad. La reducción de las variables macroscópicas a variables mecánicas como la posición, velocidad, momento lineal o energía cinética de las moléculas, que pueden relacionarse a través de las leyes de la mecánica de Newton, debería de proporcionar todas las leyes empíricas de los gases. En general, esto resulta ser cierto.
La teoría física que relaciona las propiedades de los gases con la mecánica clásica se denomina teoría cinética de los gases. Además de proporcionar una base para la ecuación de estado del gas ideal, la teoría cinética también puede emplearse para predecir muchas otras propiedades de los gases, entre ellas la distribución estadística de las velocidades moleculares y las propiedades de transporte como la conductividad térmica, el coeficiente de difusión o la viscosidad.
Los conceptos dados sobre la teoría cinética molecular permiten derivar una ecuación fundamental aplicable a todos los gases ideales. Consideremos un recipiente cúbico, con una arista de longitud (l), en el cual hay una molécula de un gas de masa (m) que se mueve a una velocidad (v). La molécula se dirige hacia la pared del lado derecho con un momento = mv (momento - masa X velocidad). Cuando choca contra la pared derecha rebota elásticamente, dirigiéndose a la pared opuesta, por lo que su velocidad será (- v) (para indicar la dirección, ver cantidades vectoriales en el Apéndice); luego su momento será = - mv. El cambio de momento por cada choque será:
mv - (- mv) = 2 mv
Teniendo en cuenta que la molécula debe ir hacia la pared del lado izquierdo y rebotar, antes de que pueda volver a chocar contra la pared del lado derecho, se deduce que el número de choques contra la pared del lado
derecho por segundo es( ) y el cambio de momento por molécula por segundo es:
(1)
Suponiendo que el cubo está lleno de n moléculas, las moléculas estarán moviéndose al azar en todas direcciones. Por razones estadísticas, se puede considerar que las moléculas están divididas en tres conjuntos iguales ( ); un conjunto que se mueve de la pared derecha a la de la izquierda y viceversa; otro que se mueve de arriba a abajo y el tercero que se mueve del lado anterior al posterior. Considerando las moléculas (tomando v2 como velocidad media), por segundo es . Según las leyes de Newton, sobre el movimiento, (ver Apéndice) la razón del cambio, en el momento, es igual a la fuerza impulsora. La fuerza impulsora que actúa sobre la cara del lado derecho, será . Como la presión (P) es una fuerza entre unidad de área y como el área de un cubo es 12 tenemos:
(2)
y como 13 = volumen (v) substituyendo obtenemos la ecuación fundamental de la teoría cinética
(3)
Deducciones a parir de la ecuación fundamental de la teoría cinética
A partir de la ecuación cinética (3) se pueden deducir las leyes de los gases. Así, multiplicando por 2 el numerador y el denominador de la ecuación (3), obtenemos
Como la energía cinética promedio de una molécula es igual a la cantidad entre paréntesis en (4) representa la energía cinética de todas las moléculas, por lo que si la temperatura permanece constante, la energía cinética de las moléculas también será constante, es decir:
(5)
o sea
PV = K
que es lo expresado por la ley de Boyle-Mariotte.
Según la ley de Avogadro, volúmenes iguales de gases (indicados con el Indice 1 y 2) a la misma temperatura y a la misma presión contienen el mismo número de moléculas, por lo que
(6)
Como la temperatura es constante, las energías cinéticas promedio por molécula son iguales , lo que nos permite escribir la siguiente ecuación:
(7)
simplificando y tomando en cuenta la igualdad de las energías cinéticas:
n1 = n2
Como la energía cinética promedio por molécula es y según la teoría cinética esta energía es propornal a la temperatura absoluta (y a las temperaturas en otras escalas), podemos explicar la ley de difusión de Graham mediante las siguientes ecuaciones:
(8)
Si dos gases de masas m1 y m2 están a la misma temperatura, entonces
Así que:
Comparando la teoría cinética de los gases con la información experimental sobre los gases, es posible evaluar la energía cinética promedio ( ). Así usando la ecuación (6) y multiplicando ambos miembros por 2 y después pasando uno de estos factores al otro miembro, tenemos
(9)
Considerando que n es el número de moléculas y que ésta es igual al número de moles (moles n) por el número de Avogadro (6.02 X 1023 = No)
N = nNo
y substituyendo en (9)
Como la evidencia experimental ha demostrado que: PV = nRT, podemos escribir
Por lo que
Como es la energía cinética de una sola molécula, No será la energía cinética total de
una mol de gas. Es decir la energía cinética de una mol de un gas.
Es decir, la temperatura es un parámetro relacionado con la energía translacional de una molécula. La energía cinética promedio de una sola molécula se obtiene dividiendo la energía total de una mol entre No (el número de Avogadro). A la constante se le llama constante de Boltzmann (KB) y es muy importante
Tanto nRT como PV tienen las dimensiones de la energía.
La teoría física que relaciona las propiedades de los gases con la mecánica clásica se denomina teoría cinética de los gases. Además de proporcionar una base para la ecuación de estado del gas ideal, la teoría cinética también puede emplearse para predecir muchas otras propiedades de los gases, entre ellas la distribución estadística de las velocidades moleculares y las propiedades de transporte como la conductividad térmica, el coeficiente de difusión o la viscosidad.
Los conceptos dados sobre la teoría cinética molecular permiten derivar una ecuación fundamental aplicable a todos los gases ideales. Consideremos un recipiente cúbico, con una arista de longitud (l), en el cual hay una molécula de un gas de masa (m) que se mueve a una velocidad (v). La molécula se dirige hacia la pared del lado derecho con un momento = mv (momento - masa X velocidad). Cuando choca contra la pared derecha rebota elásticamente, dirigiéndose a la pared opuesta, por lo que su velocidad será (- v) (para indicar la dirección, ver cantidades vectoriales en el Apéndice); luego su momento será = - mv. El cambio de momento por cada choque será:
mv - (- mv) = 2 mv
Teniendo en cuenta que la molécula debe ir hacia la pared del lado izquierdo y rebotar, antes de que pueda volver a chocar contra la pared del lado derecho, se deduce que el número de choques contra la pared del lado
derecho por segundo es( ) y el cambio de momento por molécula por segundo es:
(1)
Suponiendo que el cubo está lleno de n moléculas, las moléculas estarán moviéndose al azar en todas direcciones. Por razones estadísticas, se puede considerar que las moléculas están divididas en tres conjuntos iguales ( ); un conjunto que se mueve de la pared derecha a la de la izquierda y viceversa; otro que se mueve de arriba a abajo y el tercero que se mueve del lado anterior al posterior. Considerando las moléculas (tomando v2 como velocidad media), por segundo es . Según las leyes de Newton, sobre el movimiento, (ver Apéndice) la razón del cambio, en el momento, es igual a la fuerza impulsora. La fuerza impulsora que actúa sobre la cara del lado derecho, será . Como la presión (P) es una fuerza entre unidad de área y como el área de un cubo es 12 tenemos:
(2)
y como 13 = volumen (v) substituyendo obtenemos la ecuación fundamental de la teoría cinética
(3)
Deducciones a parir de la ecuación fundamental de la teoría cinética
A partir de la ecuación cinética (3) se pueden deducir las leyes de los gases. Así, multiplicando por 2 el numerador y el denominador de la ecuación (3), obtenemos
Como la energía cinética promedio de una molécula es igual a la cantidad entre paréntesis en (4) representa la energía cinética de todas las moléculas, por lo que si la temperatura permanece constante, la energía cinética de las moléculas también será constante, es decir:
(5)
o sea
PV = K
que es lo expresado por la ley de Boyle-Mariotte.
Según la ley de Avogadro, volúmenes iguales de gases (indicados con el Indice 1 y 2) a la misma temperatura y a la misma presión contienen el mismo número de moléculas, por lo que
(6)
Como la temperatura es constante, las energías cinéticas promedio por molécula son iguales , lo que nos permite escribir la siguiente ecuación:
(7)
simplificando y tomando en cuenta la igualdad de las energías cinéticas:
n1 = n2
Como la energía cinética promedio por molécula es y según la teoría cinética esta energía es propornal a la temperatura absoluta (y a las temperaturas en otras escalas), podemos explicar la ley de difusión de Graham mediante las siguientes ecuaciones:
(8)
Si dos gases de masas m1 y m2 están a la misma temperatura, entonces
Así que:
Comparando la teoría cinética de los gases con la información experimental sobre los gases, es posible evaluar la energía cinética promedio ( ). Así usando la ecuación (6) y multiplicando ambos miembros por 2 y después pasando uno de estos factores al otro miembro, tenemos
(9)
Considerando que n es el número de moléculas y que ésta es igual al número de moles (moles n) por el número de Avogadro (6.02 X 1023 = No)
N = nNo
y substituyendo en (9)
Como la evidencia experimental ha demostrado que: PV = nRT, podemos escribir
Por lo que
Como es la energía cinética de una sola molécula, No será la energía cinética total de
una mol de gas. Es decir la energía cinética de una mol de un gas.
Es decir, la temperatura es un parámetro relacionado con la energía translacional de una molécula. La energía cinética promedio de una sola molécula se obtiene dividiendo la energía total de una mol entre No (el número de Avogadro). A la constante se le llama constante de Boltzmann (KB) y es muy importante
Tanto nRT como PV tienen las dimensiones de la energía.
EJEMPLO
A 0 ºC 11 velocidad promedio de una molécula de O2 es de 4.25 X 104 cm/seg. ¿Cuál sería su velocidad promedio si la temperatura fuera de 25 ºC?
T a energía cinética ( ) es proporcional a la temperatura absoluta, que en este ejemplo cambia de 273 ºK (FC) a 298 ºK (25 ºC).
Por lo que:
A 0 ºC 11 velocidad promedio de una molécula de O2 es de 4.25 X 104 cm/seg. ¿Cuál sería su velocidad promedio si la temperatura fuera de 25 ºC?
T a energía cinética ( ) es proporcional a la temperatura absoluta, que en este ejemplo cambia de 273 ºK (FC) a 298 ºK (25 ºC).
Por lo que:
DIFUSIÓN Y EFUSIÓN DE GASES
La difusión es el proceso por el cual una substancia se distribuye uniformemente en el espacio que la encierra o en el medio en que se encuentra. Por ejemplo: si se conectan dos tanques conteniendo el mismo gas a diferentes presiones, en corto tiempo la presión es igual en ambos tanques. También si se introduce una pequeña cantidad de gas A en un extremo de un tanque cerrado que contiene otro gas B, rápidamente el gas A se distribuirá uniformemente por todo el tanque. La difusión es una consecuencia del movimiento continuo y elástico de las moléculas gaseosas. Gases diferentes tienen distintas velocidades de difusión. Para obtener información cuantitativa sobre las velocidades de difusión se han hecho muchas determinaciones. En una técnica el gas se deja pasar por orificios pequeños a un espacio totalmente vacío; la distribución en estas condiciones se llama efusión y la velocidad de las moléculas es igual que en la difusión. Los resultados son expresados por la ley de Graham. "La velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su densidad."
en donde v1 y v2 son las velocidades de difusión de los gases que se comparan y d1 y d2 son las densidades. Las densidades se pueden relacionar con la masa y el volumen porque ( ); cuando M sea igual a la masa (peso) v molecular y v al volumen molecular, podemos establecer la siguiente relación entre las velocidades de difusión de dos gases y su peso molecular:
y como los volúmenes moleculares de los gases en condiciones iguales de temperatura y presión son idénticos, es decir V1 = V2, en la ecuación anterior sus raíces cuadradas se cancelan, quedando:
Es decir: la velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su peso molecular
en donde v1 y v2 son las velocidades de difusión de los gases que se comparan y d1 y d2 son las densidades. Las densidades se pueden relacionar con la masa y el volumen porque ( ); cuando M sea igual a la masa (peso) v molecular y v al volumen molecular, podemos establecer la siguiente relación entre las velocidades de difusión de dos gases y su peso molecular:
y como los volúmenes moleculares de los gases en condiciones iguales de temperatura y presión son idénticos, es decir V1 = V2, en la ecuación anterior sus raíces cuadradas se cancelan, quedando:
Es decir: la velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su peso molecular
SOFTWARE ASOCIADO A LA ENSEÑANZA DE LA QUÍMICA
· http://www.formacionenlinea.edu.ve/formacion_educadores/formacion-educadores/curso_quimica/contenido_curso.html
El curso tiene cuatro unidades: 1) Historia de la química; 2) Cálculos de longitud, masa, volumen y temperatura; 3) Estructura de la tabla periódica y 4) Símbolos y números asociados de los elementos químicos. Cada unidad se fracciona en lecciones y cada lección finaliza con una actividad. Además, al culminar la unidad, presenta un resumen precedido de una autoevaluación, que ayuda a verificar si se obtuvo un aprendizaje o no.
La información inicialmente se muestra en textos cortos, que contienen la explicación necesaria para que se puedan entender los temas correctamente. Lo interesante es que además permiten que uno se sitúe históricamente en el desarrollo de la química. Es muy placentero realizar el curso, además porque se realizan algunas preguntas abiertas que permiten la comparación con las ideas de un “tutor”. Además permite que se afiancen los términos más importantes y que se comparen con la vida cotidiana que re presenta una manera más fácil de aprender.
Es muy recomendable para las personas que se encuentran aprendiendo química básica no sólo a nivel profesional, sino a nivel de media vocacional. Por lo anterior se pude concluir que es un muy buen material para el aprendizaje de la química.
· http://www.formacionenlinea.edu.ve/formacion_educadores/formacion-educadores/curso_quimica/contenido_curso.html
El curso tiene cuatro unidades: 1) Historia de la química; 2) Cálculos de longitud, masa, volumen y temperatura; 3) Estructura de la tabla periódica y 4) Símbolos y números asociados de los elementos químicos. Cada unidad se fracciona en lecciones y cada lección finaliza con una actividad. Además, al culminar la unidad, presenta un resumen precedido de una autoevaluación, que ayuda a verificar si se obtuvo un aprendizaje o no.
La información inicialmente se muestra en textos cortos, que contienen la explicación necesaria para que se puedan entender los temas correctamente. Lo interesante es que además permiten que uno se sitúe históricamente en el desarrollo de la química. Es muy placentero realizar el curso, además porque se realizan algunas preguntas abiertas que permiten la comparación con las ideas de un “tutor”. Además permite que se afiancen los términos más importantes y que se comparen con la vida cotidiana que re presenta una manera más fácil de aprender.
Es muy recomendable para las personas que se encuentran aprendiendo química básica no sólo a nivel profesional, sino a nivel de media vocacional. Por lo anterior se pude concluir que es un muy buen material para el aprendizaje de la química.




